0
įŁūėĄ─śŗ│╔
ó▒śŗ│╔įŁūėĄ─┴Żūė

ó▓į┌įŁūė└’�����Ż¼║╦ļŖ║╔öĄ=┘|(zh©¼)ūėöĄ=║╦═ŌļŖūėöĄ��Ż¼įŁūė▓╗’@ļŖąį�ĪŻ
0
ŽÓī”įŁūė┘|(zh©¼)┴┐
ó▒ŽÓī”įŁūė┘|(zh©¼)┴┐Ą─ś╦£╩Ż║╠╝-12įŁūė┘|(zh©¼)┴┐Ą─1/12�����ĪŻ
ó▓▒Ē▀_╩ĮŻ║Ar=Ųõ╦¹įŁūėĄ─┘|(zh©¼)┴┐/(╠╝-12Ą─┘|(zh©¼)┴┐×1/12)
ŽÓī”įŁūė┘|(zh©¼)┴┐╩Ūę╗éĆ(g©©)▒╚ųĄ�Ż¼▓╗╩ŪįŁūėĄ─īŹ(sh©¬)ļH┘|(zh©¼)┴┐����ĪŻ
ó│įŁūėĄ─┘|(zh©¼)┴┐ų„ę¬╝»ųąį┌įŁūė║╦╔Ž��Ż¼ŽÓī”įŁūė┘|(zh©¼)┴┐≈┘|(zh©¼)ūėöĄ+ųąūėöĄ
0
į¬╦ž
ó▒į¬╦žĄ─Č©┴xŻ║Š▀ėąŽÓ═¼║╦ļŖ║╔öĄ(╝┤║╦ā╚┘|(zh©¼)ūėöĄ)Ą─ę╗ŅÉ(l©©i)įŁūėĄ─┐éĘQ(ch©źng)�ĪŻ
ó▓į¬╦žĄ─ĘNŅÉ(l©©i)øQČ©ė┌║╦ļŖ║╔öĄ(╝┤║╦ā╚┘|(zh©¼)ūėöĄ)�ĪŻ
ó│ĄžÜżųą║¼┴┐┴ąŪ░╦─╬╗Ą─į¬╦ž(┘|(zh©¼)┴┐ĘųöĄ)Ż║č§����Īó╣Ķ�ĪóõX��ĪóĶF���Ż¼Ųõųą║¼┴┐ūŅČÓĄ─į¬╦ž(ĘŪĮī┘į¬╦ž)╩Ūč§�����Ż¼║¼┴┐ūŅČÓĄ─Įī┘į¬╦ž╩ŪõX����ĪŻ
ó┤╔·╬’╝Ü░¹ųą║¼┴┐┴ąŪ░╦─╬╗Ą─į¬╦žŻ║č§���Īó╠╝��ĪóÜõ����ĪóĄ¬�����ĪŻ
0
į¬╦žĘ¹╠¢
ó▒į¬╦žĘ¹╠¢Ż║ė├į¬╦žĄ─└ŁČĪ╬─├¹ĘQ(ch©źng)Ą─Ą┌ę╗éĆ(g©©)┤¾īæ(xi©¦)ūų─ĖüĒ(l©ói)į¬╦ž�ĪŻ
ó▓Ģ°(sh©▒)īæ(xi©¦)Ż║
ó┼ė╔ę╗éĆ(g©©)ūų─Ė▒Ē╩ŠĄ─į¬╦žĘ¹╠¢ę¬┤¾īæ(xi©¦)���Ż¼╚ńŻ║H��ĪóO����ĪóS�ĪóC�ĪóPĄ╚���ĪŻ
óŲė╔ā╔éĆ(g©©)ūų─Ė▒Ē╩ŠĄ─į¬╦žĘ¹╠¢���Ż¼Ą┌ę╗éĆ(g©©)ūų─Ėę¬┤¾īæ(xi©¦)���Ż¼Ą┌Č■éĆ(g©©)ūų─ĖꬹĪīæ(xi©¦)(╝┤“ę╗┤¾Č■ąĪ”)���Ż¼╚ńŻ║Ca���ĪóNa����ĪóMg���ĪóZnĄ╚����ĪŻ
ó│į¬╦žĘ¹╠¢▒Ē╩ŠĄ─ęŌ┴xŻ║ó┼▒Ē╩Šę╗ĘNį¬╦ž;óŲ▒Ē╩Š▀@ĘNį¬╦žĄ─ę╗éĆ(g©©)įŁūė���ĪŻ└²╚ńŻ║
HŻ║ó┘▒Ē╩ŠÜõį¬╦ž
ó┌▒Ē╩Šę╗éĆ(g©©)ÜõįŁūė
2HŻ║▒Ē╩ŠČ■éĆ(g©©)ÜõįŁūė��Ż¼2H▓╗─▄šf(shu©Ł)│╔Č■éĆ(g©©)Üõį¬╦ž
ūóęŌŻ║į¬╦žų╗ųvĘNŅÉ(l©©i)����Ż¼▓╗ųvéĆ(g©©)öĄ;įŁūė╝┤ųvĘNŅÉ(l©©i)����Ż¼ėųųvéĆ(g©©)öĄ���ĪŻ
0
╬’┘|(zh©¼)ĮM│╔����Īóśŗ│╔Ą─├Ķ╩÷
ó▒╬’┘|(zh©¼)ė╔į¬╦žĮM│╔Ż║╚ń╦«╩Ūė╔Üõį¬╦ž║═č§į¬╦žĮM│╔Ą─��ĪŻ
ó▓╬’┘|(zh©¼)ė╔┴Żūė(Ęųūė�ĪóįŁūė���Īóļxūė)śŗ│╔�ĪŻ└²╚ńŻ║
ó┼╦«╩Ūė╔╦«Ęųūėśŗ│╔Ą─����ĪŻ
óŲĮ╩Ūė╔ĮįŁūėśŗ│╔Ą─�ĪŻ
óŪ┬╚╗»Ōc╩Ūė╔Ōcļxūė║═┬╚ļxūėśŗ│╔Ą─�����ĪŻ
ó│Ęųūė╩Ūė╔įŁūėśŗ│╔Ą─�����ĪŻ
╚ńŻ║╦«Ęųūė╩Ūė╔ÜõįŁūė║═č§įŁūėśŗ│╔Ą─;├┐éĆ(g©©)╦«Ęųūė╩Ūė╔Č■éĆ(g©©)ÜõįŁūė║═ę╗éĆ(g©©)č§įŁūėśŗ│╔Ą─���ĪŻ
0
į¬╦žų▄Ų┌▒Ē║å(ji©Żn)Įķ
ó▒į¬╦žų▄Ų┌▒Ē
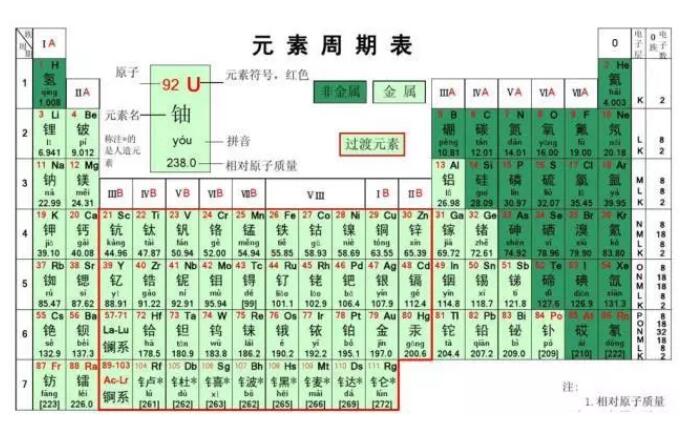
ó┼ų▄Ų┌▒Ē├┐ę╗ÖMąąĮąū÷ę╗éĆ(g©©)ų▄Ų┌����Ż¼╣▓ėą7éĆ(g©©)ų▄Ų┌�ĪŻ
óŲų▄Ų┌▒Ē├┐ę╗éĆ(g©©)┐vąąĮąū÷ę╗ūÕ��Ż¼╣▓ėą16éĆ(g©©)ūÕ(8���Īó9����Īó10╚²éĆ(g©©)┐vąą╣▓═¼ĮM│╔ę╗éĆ(g©©)ūÕ)��ĪŻ
ó▓į¬╦žų▄Ų┌▒ĒĄ─ęŌ┴x
ó┼╩ŪīW(xu©”)┴Ģ║═蹊┐╗»īW(xu©”)ų¬ūRĄ─ųžę¬╣żŠ▀;
óŲ×ķīżšęą┬į¬╦ž╠ß╣®┴╦└Ēšōę└ō■;
óŪė╔ė┌į┌į¬╦žų▄Ų┌▒Ēųą╬╗ų├įĮ┐┐Į³Ą─į¬╦ž��Ż¼ąį┘|(zh©¼)įĮŽÓ╦Ų����Ż¼┐╔ęįåó░l(f©Ī)╚╦éāį┌į¬╦žų▄Ų┌▒ĒĄ─ę╗Č©ģ^ė“īżšęą┬╬’┘|(zh©¼)(╚ń▐r╦Ä�Īó┤▀╗»ä®���Īó░ļī¦¾w▓─┴ŽĄ╚)����ĪŻ
0
║╦═ŌļŖūėĄ─Ęųīė┼┼▓╝
ó▒ļŖūė┼┼▓╝——Ęųīė┼┼▓╝Ż║Ą┌ę╗īė▓╗│¼▀^(gu©░)2éĆ(g©©);Ą┌Č■īė▓╗│¼▀^(gu©░)8éĆ(g©©);……ūŅ═Ōīė▓╗│¼▀^(gu©░)8éĆ(g©©)��ĪŻ
ó▓įŁūėĮYśŗ╩ŠęŌłDŻ║
ó┼║¼┴xŻ║(ęįµVįŁūėĮYśŗ╩ŠęŌłD×ķ└²)

óŲįŁūėĄ─ūŅ═ŌīėļŖūėöĄ┼cį¬╦žĄ─ĘųŅÉ(l©©i)��Īó╗»īW(xu©”)ąį┘|(zh©¼)Ą─ĻP(gu©Īn)ŽĄ

ó┘į¬╦žĄ─╗»īW(xu©”)ąį┘|(zh©¼)øQČ©ė┌įŁūėĄ─ūŅ═ŌīėļŖūėöĄ�ĪŻ
ó┌įŁūėūŅ═ŌīėļŖūėöĄ×ķ8(║ż×ķ2)Ą─ĮYśŗĘQ(ch©źng)×ķĘĆČ©ĮYśŗ�����ĪŻ
óŪįŁūė���ĪóĻ¢(y©óng)ļxūė��ĪóĻÄļxūėĄ─┼ąöÓ
ó┘ įŁūėŻ║┘|(zh©¼)ūėöĄ=║╦═ŌļŖūėöĄ
ó┌ ĻÄļxūėŻ║┘|(zh©¼)ūėöĄ<║╦═ŌļŖūėöĄ
ó█ Ļ¢(y©óng)ļxūėŻ║┘|(zh©¼)ūėöĄ>║╦═ŌļŖūėöĄ
0
ļxūė
ó▒Č©┴xŻ║ĦļŖ║╔Ą─įŁūė(╗“įŁūėłF)����ĪŻ
ó▓ĘųŅÉ(l©©i)(ūóŻ║▒Š╬─ųą╝ė£pŠ∙×ķ╔Žś╦)
Ļ¢(y©óng)ļxūėŻ║Ħš²ļŖ║╔Ą─ļxūė�����Ż¼╚ńNa+����ĪóMg2+
ĻÄļxūėŻ║ĦžōļŖ║╔Ą─ļxūė����Ż¼╚ńCl-����ĪóO2-
ó│ļxūėĘ¹╠¢▒Ē╩ŠĄ─ęŌ┴xŻ║▒Ē╩Šļxūė(╗“ę╗éĆ(g©©)ļxūė)�����Ż¼╚ńŻ║Mg2+——▒Ē╩ŠµVļxūė(ę╗éĆ(g©©)µVļxūė)
2Mg2+——Ą┌ę╗éĆ(g©©)2▒Ē╩Šā╔éĆ(g©©)µVļxūė
Ą┌Č■éĆ(g©©)2▒Ē╩Š├┐éĆ(g©©)µVļxūėĦā╔éĆ(g©©)å╬╬╗Ą─š²ļŖ║╔
ó┼ļxūėĘ¹╠¢Ū░├µĄ─╗»īW(xu©”)ėŗ┴┐öĄ(ŽĄöĄ)▒Ē╩ŠļxūėĄ─éĆ(g©©)öĄ;
óŲļxūėĘ¹╠¢Ą─▒Ē╩ŠĘĮĘ©Ż║į┌į¬╦žĘ¹╠¢(╗“įŁūėłF)ėę╔ŽĮŪ▒Ē├„ļxūė╦∙ĦĄ─ļŖ║╔�����Ż¼öĄųĄį┌Ū░��Ż¼š²��Īóžō╠¢į┌║¾�����ĪŻļxūėĦ1éĆ(g©©)å╬╬╗Ą─š²ļŖ║╔╗“éĆ(g©©)å╬╬╗Ą─žōļŖ║╔����Ż¼“1”╩Ī┬į▓╗īæ(xi©¦)���ĪŻ╚ńŻ║Ļ¢(y©óng)ļxūėŻ║Na+��ĪóCa2+�����ĪóAl3+Ą╚�����Ż¼ĻÄļxūėŻ║Cl-����ĪóS2‑Ą╚
ó┤ėąĻP(gu©Īn)ļxūėĄ─ąĪĮY
ó┼Įī┘ļxūėĦš²ļŖ║╔�����Ż¼ĘŪĮī┘ļxūėĦžōļŖ║╔;
óŲļxūė╦∙ĦĄ─ļŖ║╔=įōį¬╦žĄ─╗»║Žār(ji©ż)
óŪ│ŻęŖ(ji©żn)įŁūėłFļxūė(šłūóęŌ╔ŽŽ┬ś╦)
SO42- ┴“╦ßĖ∙ļxūė CO32- ╠╝╦ßĖ∙ļxūė
NO3- Ž§╦ßĖ∙ļxūė OH- Üõč§Ė∙ļxūė
NH4+ õ@Ė∙ļxūė
0
╗»īW(xu©”)╩Į
ó▒╗»īW(xu©”)╩ĮĄ─īæ(xi©¦)Ę©
A.å╬┘|(zh©¼)Ą─╗»īW(xu©”)╩Į
ó┼ļpįŁūėĘųūėĄ─╗»īW(xu©”)╩Į����Ż¼╚ńŻ║ÜõÜŌ——H2���Ż¼č§ÜŌ——O2����Ż¼Ą¬ÜŌ——N2����Ż¼┬╚ÜŌ——Cl2�����ĪŻ
óŲŽĪėąÜŌ¾w���ĪóĮī┘┼c╣╠¾wĘŪĮī┘å╬┘|(zh©¼)Ż║ė╔įŁūėśŗ│╔�Ż¼╦³éāĄ─╗»īW(xu©”)╩Įė├į¬╦žĘ¹╠¢üĒ(l©ói)▒Ē╩Š�����ĪŻ
B.╗»║Ž╬’Ą─╗»īW(xu©”)╩Į
š²ār(ji©ż)īæ(xi©¦)ū¾▀ģ���Ż¼žōār(ji©ż)īæ(xi©¦)ėę▀ģ�Ż¼═¼Ģr(sh©¬)š²��Īóžō╗»║Žār(ji©ż)Ą─┤·öĄ║═×ķ┴Ń�ĪŻ
ó▓Äū³c(di©Żn)ūóęŌ╩┬ĒŚ
ó┼ę╗ĘN╬’┘|(zh©¼)ų╗ėąę╗éĆ(g©©)╗»īW(xu©”)╩Į��Ż¼Ģ°(sh©▒)īæ(xi©¦)╗»īW(xu©”)╩ĮĢr(sh©¬)���Ż¼ę¬┐╝æ]ĄĮį¬╦žĄ─┼┼┴ąĒśą“���Ż¼▀Ćę¬┐╝æ]ĄĮ▒Ē╩ŠįŁūėéĆ(g©©)öĄĄ─ĮŪ┤aæ¬īæ(xi©¦)Ą─▓┐╬╗���ĪŻ
óŲę╗░Ń╗»║Ž╬’Ą─ųą╬─├¹ĘQ(ch©źng)�Ż¼ŲõĒśą“║═╗»īW(xu©”)╩ĮĢ°(sh©▒)īæ(xi©¦)Ą─Ēśą“š²║├ŽÓĘ┤����ĪŻ
ó│╗»īW(xu©”)╩ĮĄ─║Ł┴x(ęįCO2×ķ└²šf(shu©Ł)├„)
ó┼║Ļė^(gu©Īn)╔Ž
▒Ē╩Šę╗ĘN╬’┘|(zh©¼)Ż║▒Ē╩ŠČ■č§╗»╠╝��ĪŻ
▒Ē╩Šįō╬’┘|(zh©¼)ė╔──ą®į¬╦žĮM│╔Ż║▒Ē╩ŠČ■č§╗»╠╝ė╔╠╝į¬╦ž║═č§į¬╦žĮM│╔��ĪŻ
óŲ╬óė^(gu©Īn)╔Ž
▒Ē╩Šįō╬’┘|(zh©¼)Ą─ę╗éĆ(g©©)ĘųūėŻ║▒Ē╩Šę╗éĆ(g©©)Č■č§╗»╠╝Ęųūė��ĪŻ
▒Ē╩ŠĘųūėĄ─śŗ│╔Ż║▒Ē╩Š├┐éĆ(g©©)Č■č§╗»╠╝Ęųūėė╔ę╗éĆ(g©©)╠╝įŁūė║═Č■éĆ(g©©)č§įŁūėśŗ│╔�ĪŻ
10
╗»║Žār(ji©ż)
ó▒į¬╦ž╗»║Žār(ji©ż)Ą─▒Ē╩ŠĘĮĘ©
╗»║Žār(ji©ż)ė├+1���Īó+2�����Īó+3�����Īó-1�Īó-2……▒Ē╩Š��Ż¼ś╦į┌į¬╦žĘ¹╠¢Ą─š²╔ŽĘĮ��Ż¼╚ńŻ║Na�����Īó Cl�Īó Mg�����Īó O�����ĪŻę¬ūóęŌ╗»║Žār(ji©ż)Ą─▒Ē╩ŠĘĮĘ©┼cļxūėĘ¹╠¢Ą─ģ^äe��Ż¼ļxūė╦∙ĦļŖ║╔Ę¹╠¢ė├+�Īó2+����Īó-��Īó2-……▒Ē╩Š��Ż¼ś╦į┌į¬╦žĘ¹╠¢Ą─ėę╔ŽĮŪ����Ż¼╚ńŻ║

ó▓į¬╦ž╗»║Žār(ji©ż)Ą─ę╗░ŃęÄ┬╔
ó┼Üõį¬╦žĄ─╗»║Žār(ji©ż)═©│Ż’@+1ār(ji©ż)����Ż¼č§į¬╦žĄ─╗»║Žār(ji©ż)’@-2ār(ji©ż)����ĪŻ
óŲį┌╗»║Ž╬’ųą�Ż¼Įī┘į¬╦ž×ķš²ār(ji©ż)����ĪŻ
óŪĘŪĮī┘┼cÜõ╗“Įī┘╗»║ŽĢr(sh©¬)��Ż¼ĘŪĮī┘į¬╦ž’@žōār(ji©ż);ĘŪĮī┘┼cč§į¬╦ž╗»║ŽĢr(sh©¬)��Ż¼ĘŪĮī┘į¬╦ž’@š²ār(ji©ż)���ĪŻ
ó╚į┌╗»║Ž╬’ųą���Ż¼š²�Īóžō╗»║Žār(ji©ż)Ą─┤·öĄ║═×ķ┴Ń��ĪŻ
ó╔į┌å╬┘|(zh©¼)ųąį¬╦žĄ─╗»║Žār(ji©ż)×ķ┴Ń���ĪŻ
ó│└╬ėø│ŻęŖ(ji©żn)į¬╦žĄ─╗»║Žār(ji©ż)

ó┤│ŻęŖ(ji©żn)Ė∙(įŁūėłF)Ą─╗»║Žār(ji©ż)

│ŻęŖ(ji©żn)į¬╦žĄ─╗»║Žār(ji©ż)(š²ār(ji©ż))Ż║
ę╗ār(ji©ż)ŌøŌcÜõ┼cŃy���Ż¼Č■ār(ji©ż)Ō}µVõ^┼cõ\���Ż¼╚²ār(ji©ż)Įī┘į¬╦žõX;
ę╗╬ÕŲ▀ūāār(ji©ż)┬╚����Ż¼Č■╦─╬ÕĄ¬����Ż¼┴“╦─┴∙�����Ż¼╚²╬Õėą┴ū�Ż¼Č■╦─╠╝;
ę╗Č■Ń~���Ż¼Č■╚²ĶF���Ż¼Č■╦─┴∙Ų▀Õi╠žäe�����ĪŻ
óĄ╗»║Žār(ji©ż)Ą─æ¬ė├
ó┼Öz“×╗»īW(xu©”)╩ĮĄ─š²š`;
óŲĖ∙ō■╗»īW(xu©”)╩Į┼ąöÓį¬╦žĄ─╗»║Žār(ji©ż);
óŪĖ∙ō■į¬╦žĄ─╗»║Žār(ji©ż)═ŲŪ¾īŹ(sh©¬)ļH┤µį┌╬’┘|(zh©¼)Ą─╗»īW(xu©”)╩Į����ĪŻ
1
ėąĻP(gu©Īn)╗»īW(xu©”)╩ĮĄ─ėŗ╦Ń
ó▒ėŗ╦Ń╬’┘|(zh©¼)Ą─ŽÓī”Ęųūė┘|(zh©¼)┴┐=Ė„į¬╦žĄ─ŽÓī”įŁūė┘|(zh©¼)┴┐×įŁūėéĆ(g©©)öĄų«║═
ó▓ėŗ╦Ń╬’┘|(zh©¼)ĮM│╔į¬╦žĄ─┘|(zh©¼)┴┐▒╚=Ė„į¬╦žĄ─ŽÓī”įŁūė┘|(zh©¼)┴┐×įŁūėéĆ(g©©)öĄų«▒╚
ó│ėŗ╦Ń╬’┘|(zh©¼)ųą─│į¬╦žĄ─┘|(zh©¼)┴┐ĘųöĄ
╬’┘|(zh©¼)ųą─│į¬╦žĄ─┘|(zh©¼)┴┐ĘųöĄ=(įōį¬╦žĄ─ŽÓī”įŁūė┘|(zh©¼)┴┐×įŁūėéĆ(g©©)öĄ)÷╗»║Ž╬’Ą─ŽÓī”Ęųūė┘|(zh©¼)┴┐×100%
ó┤ėŗ╦Ńę╗Č©┘|(zh©¼)┴┐Ą─╗»║Ž╬’ųą║¼─│į¬╦žĄ─┘|(zh©¼)┴┐
─│į¬╦žĄ─┘|(zh©¼)┴┐=╗»║Ž╬’Ą─┘|(zh©¼)┴┐×╗»║Ž╬’ųąįōį¬╦žĄ─┘|(zh©¼)┴┐ĘųöĄ
ūāą╬Ż║╗»║Ž╬’Ą─┘|(zh©¼)┴┐=─│į¬╦žĄ─┘|(zh©¼)┴┐÷╗»║Ž╬’ųąįōį¬╦žĄ─┘|(zh©¼)┴┐ĘųöĄ
óĄęčų¬╗»║Ž╬’ųąĖ„į¬╦žĄ─┘|(zh©¼)┴┐▒╚║═Ė„į¬╦žĄ─ŽÓī”įŁūė┘|(zh©¼)┴┐����Ż¼Ū¾įŁūėéĆ(g©©)öĄ▒╚
Ė„į¬╦žĄ─įŁūėéĆ(g©©)öĄ▒╚=Ė„į¬╦žĄ─┘|(zh©¼)┴┐/Ė„į¬╦žĄ─ŽÓī”įŁūė┘|(zh©¼)┴┐ų«▒╚
ĪĪĪĪ ÜgėŁ╩╣ė├╩ųÖC����ĪóŲĮ░ÕĄ╚ęŲäė(d©░ng)įOéõįL(f©Żng)å¢(w©©n)ųą┐╝ŠW(w©Żng)�Ż¼2023ųą┐╝ę╗┬Ę┼Ń░ķ═¼ąą���ŻĪ>>³c(di©Żn)ō¶▓ķ┐┤
















