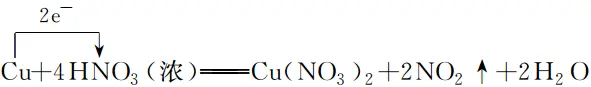├³Ņ}Ęų╬÷
1.Å─┐╝▓ķŅ}ą═┐┤Ż║ļxūė╩Ūʱ╣▓┤µĄ─┼ąöÓ���Ż¼ļxūėĘĮ│╠╩ĮĄ─Ģ°(sh©▒)īæ(xi©¦)�����Ī󚲚`┼ąöÓų„ę¬ęį▀xō±Ņ}Ą─ą╬╩Į│÷¼F����Ī�Ż┐╝▓ķč§╗»▀ĆįŁĘ┤æ¬Ą─ų¬ūR�����Ż¼Įø(j©®ng)│ŻęįĘŪ▀xō±Ņ}Ą─ą╬╩Į│÷¼F����ĪŻ
2.Å─┐╝▓ķų¬ūR³c(di©Żn)┐┤Ż║ļxūėĘĮ│╠╩ĮĄ─š²š`┼ąöÓ�����Īóļxūė─▄ʱ┤¾┴┐╣▓┤µ╦∙╔µ╝░Ą─ā╚╚▌Ė▓╔w├µÅV�Ż¼ų¬ūR╚▌┴┐┤¾�����ĪŻč§╗»▀ĆįŁĘ┤æ¬┐╝▓ķĄ─ųž³c(di©Żn)ėąŻ║┴╦ĮŌč§╗»▀ĆįŁĘ┤æ¬Ą─▒Š┘|(zh©¼)����Ż¼┴╦ĮŌč§╗»ä®║═▀ĆįŁä®Ą╚Ė┼─Ņ��ĪŻšŲ╬šųžę¬Ą─č§╗»ä®���Īó▀ĆįŁä®ų«ķgĄ─Ę┤æ¬����ĪŻ─▄┼ąöÓč§╗»▀ĆįŁĘ┤æ¬ųąļŖūė▐DęŲĄ─ĘĮŽ“║═öĄ─┐����Ż¼▓ó─▄┼õŲĮĘ┤æ¬ĘĮ│╠╩Į����ĪŻ
3.Å─├³Ņ}╦╝┬Ę╔Žų„ę¬ėąŻ║ę¬Ū¾┐╝╔·─▄╩ņŠÜšŲ╬šį┌╦«╚▄ę║ųą(▓╗═¼Śl╝■Ž┬)ļxūė─▄ʱ┤¾┴┐╣▓┤µĄ─╠ž³c(di©Żn)║═ęÄ┬╔�Ż¼─▄š²┤_Ģ°(sh©▒)īæ(xi©¦)ļxūėĘĮ│╠╩Į�ĪŻ╔µ╝░ī”─░╔·Ę┤æ¬Ą─└ĒĮŌ�Ż¼╔µ╝░ī”─░╔·Ę┤æ¬ųąč§╗»ä®��Īó▀ĆįŁä®ęį╝░č§╗»«a(ch©Żn)╬’�����Īó▀ĆįŁ«a(ch©Żn)╬’Ą╚Ą─┼ąöÓ���Ż¼─▄Ģ°(sh©▒)īæ(xi©¦)╗“┼õŲĮ─░╔·Ą─č§╗»▀ĆįŁĘ┤æ¬Ą─ļxūėĘĮ│╠╩ĮĄ╚���ĪŻ
▓▀┬į
1.╬’┘|(zh©¼)ĘųŅÉ(l©©i)Ą─ĘĮĘ©ėąČÓĘN�����Ż¼ę└ō■▓╗═¼Ą─ś╦£╩ī”╬’┘|(zh©¼)ėą▓╗═¼Ą─ĘųŅÉ(l©©i)��Ż¼Ė▀┐╝ųą═∙═∙Ģ■(hu©¼ )ŠC║Ž┐╝▓ķ╬’┘|(zh©¼)Ą─ĘųŅÉ(l©©i)�Ż¼─z¾wā╚╚▌ėą┐╝▓ķ─z¾wĄ─╗∙ĄAų¬ūR┼c┐Ų╝╝�Īó╔·╗Ņ���Īó╔·«a(ch©Żn)ŽÓĮY║ŽĄ─å¢(w©©n)Ņ}Ą─┌ģä▌�ĪŻ
2.č§╗»▀ĆįŁĘ┤æ¬ĘĮ├µĄ─Ė▀┐╝├³Ņ}┐╝▓ķ╗∙▒ŠĖ┼─ŅĄ─Ņ}─┐▌^╔┘��Ż¼é╚ųž┐╝▓ķĢ°(sh©▒)īæ(xi©¦)į┌─░╔·Łh(hu©ón)Š│Ž┬č§╗»▀ĆįŁĘ┤æ¬ĘĮ│╠╩Į��Ż¼╠žäe╩ŪĮ³Äū─Ļ│÷¼FĄ─č§╗»▀ĆįŁĄ╬Č©Ė³╩Ūīóč§╗»▀ĆįŁĘ┤æ¬ų¬ūRĄ─┐╝▓ķ╠ß╔²┴╦ę╗éĆ(g©©)īė┤╬����ĪŻ×ķ┤╦����Ż¼ī”ė┌č§╗»▀ĆįŁĘ┤æ¬ų¬ūRĄ─Å═┴Ģ��Ż¼ę╗Č©ę¬į┌└ĒŪÕ╗∙▒ŠĖ┼─ŅķgĻP(gu©Īn)ŽĄĄ─Ū░╠ߎ┬���Ż¼šŲ╬š║├ļpŠĆ(xi©żn)ś“Ę©į┌ļŖūė╩ž║Ńėŗ╦Ń�Īó┼õŲĮĘĮ├µĄ─æ¬ė├�����Ż¼╠žäe╩Ū╔µ╝░č§╗»▀ĆįŁĘ┤æ¬Ą─ėŗ╦ŃŅ}�����Ż¼Ū╔ė├ļŖūė╩ž║Ń═∙═∙┐╔ŲĄĮ╩┬░ļ╣”▒Čų«ą¦�ĪŻ
3.ļxūėĘ┤æ¬ę▓╩ŪÜv─ĻĖ▀┐╝Ą─├³Ņ}¤ß³c(di©Żn)ų«ę╗����ĪŻĮ³Äū─ĻĄ─╚½ć°ŠĒųą��Ż¼å╬¬Ü┐╝▓ķļxūėĘ┤æ¬Ą─Ņ}─┐▓╗ČÓ�Ż¼Ą½ŠĒųąČÓéĆ(g©©)ĄžĘĮėųĢ■(hu©¼ )┐╝▓ķļxūėĘ┤æ¬��Ż¼╚ń│ŻęŖ(ji©żn)ļxūėĄ─Öz“×�����Īó─░╔·Łh(hu©ón)Š│Ž┬ļxūėą═č§╗»▀ĆįŁĘ┤æ¬ĘĮ│╠╩ĮĄ─Ģ°(sh©▒)īæ(xi©¦)Ą╚�Ż¼▀@ą®═∙═∙│÷¼Fį┌īŹ(sh©¬)“×▀xō±Ņ}�ĪóīŹ(sh©¬)“׊C║ŽŅ}║═╗»īW(xu©”)╣ż╦ć┴„│╠łDŅ}ųą�����ĪŻ╦∙ęįį┌Å═┴Ģ▀@▓┐Ęųų¬ūRĢr(sh©¬)�Ż¼ę¬ėąęŌūRĄžčąŠ┐Ė▀┐╝Ņ}Ą─┐╝Ž“╠ž³c(di©Żn)�Ż¼ėąßśī”ąįĄžīóį¬╦ž╗»║Ž╬’ų¬ūR�Īóč§╗»▀ĆįŁĘ┤æ¬┼cļxūėĘ┤æ¬ų¬ūR╚┌║Žį┌ę╗Ų▀M(j©¼n)ąąė¢ŠÜ����Ż¼ęį╠ß╔²ū÷ŠC║ŽŅ}Ą──▄┴”�����ĪŻ
╬’┘|(zh©¼)Ą─ĘųŅÉ(l©©i)║═ąį┘|(zh©¼)
ę╗���Īóį¬╦ž┼c╬’┘|(zh©¼)
1.į¬╦žĄ─Ė┼─Ņ
Š▀ėąŽÓ═¼║╦ļŖ║╔öĄ(╝┤┘|(zh©¼)ūėöĄ)Ą─═¼ę╗ŅÉ(l©©i)įŁūėĄ─┐éĘQ(ch©źng)�����ĪŻ
2.į¬╦žĄ─┤µį┌ą╬æB(t©żi)
3.į¬╦ž┼c╬’┘|(zh©¼)Ą─ĻP(gu©Īn)ŽĄ
(1)╬’┘|(zh©¼)Č╝╩Ūė╔į¬╦žĮM│╔Ą─�����Ż¼├┐ę╗ĘNį¬╦žČ╝─▄ūį╔ĒĮM│╔╬’┘|(zh©¼)�����Ż¼╝┤å╬┘|(zh©¼)����ĪŻ
(2)Į^┤¾ČÓöĄį¬╦žČ╝─▄┼cŲõ╦¹ĘNŅÉ(l©©i)Ą─į¬╦žĮM│╔╬’┘|(zh©¼)���Ż¼╝┤╗»║Ž╬’��ĪŻ
Č■��Īó╬’┘|(zh©¼)Ą─ĘųŅÉ(l©©i)
1.ĘųŅÉ(l©©i)Ą─Ė┼╩÷
(1)ĘųŅÉ(l©©i)╩ŪīW(xu©”)┴Ģ║═蹊┐╗»īW(xu©”)╬’┘|(zh©¼)╝░Ųõūā╗»Ą─ę╗ĘN│Żė├┐ŲīW(xu©”)ĘĮĘ©���ĪŻ
(2)ĘųŅÉ(l©©i)æ¬ę└ō■╩┬Ž╚įOČ©Ą─“ś╦£╩”▀M(j©¼n)ąą�����Ż¼“ś╦£╩”▓╗═¼����Ż¼ĘųŅÉ(l©©i)ĘĮĘ©ę▓▓╗ŽÓ═¼�ĪŻ
2.ĘųŅÉ(l©©i)Ę©
│Żė├Ą─ā╔ĘN╩ŪĮ╗▓µĘųŅÉ(l©©i)Ę©║═śõ(sh©┤)ĀŅĘųŅÉ(l©©i)Ę©�����ĪŻ
ė╔ė┌╬’┘|(zh©¼)ĘųŅÉ(l©©i)┐╔ęįėą▓╗═¼Ą─ś╦£╩�Ż¼ę▓Š═╩Ūšf(shu©Ł)ī”─│ę╗╬’┘|(zh©¼)Č°čįŠ═┐╔ęįį┌▓╗═¼Ą─ĘųŅÉ(l©©i)ś╦£╩Ž┬“░ńč▌▓╗═¼Ą─ĮŪ╔½”�����ĪŻ
(1)Į╗▓µĘųŅÉ(l©©i)Ę©Ą─æ¬ė├╩Š└²
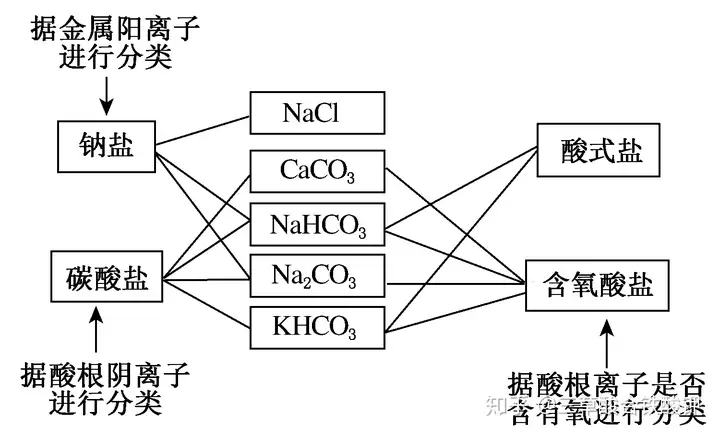
(2)śõ(sh©┤)ĀŅĘųŅÉ(l©©i)Ę©Ą─æ¬ė├╩Š└²
ó┘┴“³SĪ�����Īó┌┤╬┬╚╦ßĪ���Īó█NH3·H2O ó▄Ń~
ó▌┴“╦ßÜõŌcĪ���Īó▐NO2
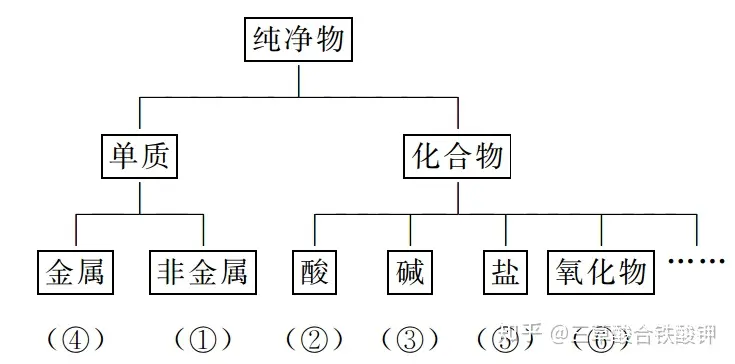
╚²����Īó╬’┘|(zh©¼)Ą─ąį┘|(zh©¼)║═ūā╗»
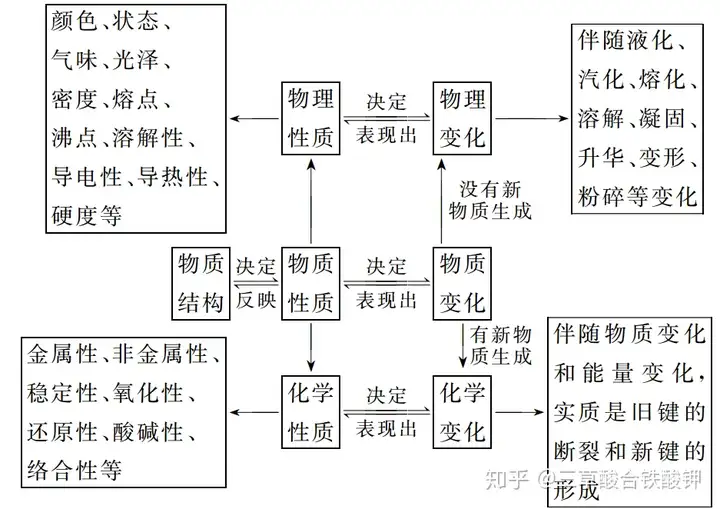
╗»īW(xu©”)ūā╗»┼c╬’└Ēūā╗»Ą─┬ō(li©ón)ŽĄŻ║╗»īW(xu©”)ūā╗»ųąę╗Č©ėą╬’└Ēūā╗»�����Ż¼Č°╬’└Ēūā╗»ųą▓╗ę╗Č©ėą╗»īW(xu©”)ūā╗»�����ĪŻ
ėąĻP(gu©Īn)═¼╦ž«Éą╬¾wę¬ūóęŌĄ─╚²éĆ(g©©)ĘĮ├µ
1.═¼╦ž«Éą╬¾wĄ─╬’└Ēąį┘|(zh©¼)▓╗═¼�ĪŻ
2.═¼╦ž«Éą╬¾wĄ─╗»īW(xu©”)ąį┘|(zh©¼)ŽÓ╦Ų�ĪŻ
3.═¼╦ž«Éą╬¾wų«ķg┐╔ęįŽÓ╗ź▐D╗»����Ż¼ī┘ė┌╗»īW(xu©”)ūā╗»���Ż¼Ą½▓╗ī┘ė┌č§╗»▀ĆįŁĘ┤æ¬�ĪŻ
╚²éĆ(g©©)┼ąöÓ
1.į¬╦ž┼cå╬┘|(zh©¼)Ą─┼ąöÓ
ę╗ĘNį¬╦žĮM│╔Ą─╬’┘|(zh©¼)┐╔─▄╩Ūå╬┘|(zh©¼)�Ż¼Ą½╩Ūę╗ĘNį¬╦ž▓╗ę╗Č©ų╗─▄ą╬│╔ę╗ĘNå╬┘|(zh©¼)�����ĪŻ╚ńO2║═O3����Ż¼Įäé╩»(C)�Īó╩»─½�ĪóC60Ą╚�Ż¼╦³éāų«ķgŠ▀ėą═¼╦ž«Éą╬¾wĻP(gu©Īn)ŽĄ��Ż¼▓╗╩Ū═¼ę╗ĘNĘųūė���Ż¼╗ņ║Žį┌ę╗Ųæ¬ī┘ė┌╗ņ║Ž╬’���ĪŻ
2.č§╗»╬’Ą─ŅÉ(l©©i)äe┼ąöÓ
(1)╦ßąįč§╗»╬’▓╗ę╗Č©╩ŪĘŪĮī┘č§╗»╬’�����Ż¼╚ńMn2O7;ĘŪĮī┘č§╗»╬’ę▓▓╗ę╗Č©╩Ū╦ßąįč§╗»╬’����Ż¼╚ńCO��ĪóNO����ĪŻ
(2)ēAąįč§╗»╬’ę╗Č©╩ŪĮī┘č§╗»╬’���Ż¼Ą½Įī┘č§╗»╬’▓╗ę╗Č©╩ŪēAąįč§╗»╬’����Ż¼╚ńMn2O7╩Ū╦ßąįč§╗»╬’����Ż¼Al2O3╩Ūā╔ąįč§╗»╬’�ĪŻ
(3)╦ßąįč§╗»╬’��ĪóēAąįč§╗»╬’ą╬│╔ī”æ¬Ą─╦ß����ĪóēAĢr(sh©¬)��Ż¼į¬╦ž╗»║Žār(ji©ż)▓╗ūā�ĪŻ
(4)╦ßąįč§╗»╬’�ĪóēAąįč§╗»╬’▓╗ę╗Č©Č╝─▄┼c╦«Ę┤æ¬╔·│╔ŽÓæ¬Ą─╦ß����ĪóēA(╚ńSiO2�����ĪóFe2O3)�ĪŻ
3.╬’└Ēūā╗»║═╗»īW(xu©”)ūā╗»Ą─┼ąöÓĘĮĘ©
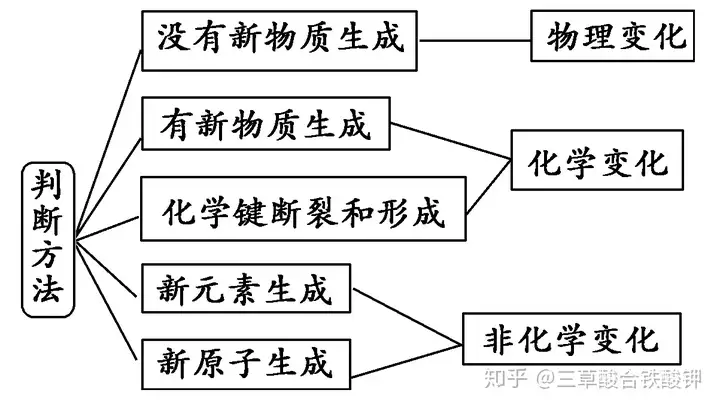
(1)│ŻęŖ(ji©żn)Ą─╬’└Ēūā╗»Ż║ó┘╬’┘|(zh©¼)╚²æB(t©żi)ūā╗»;ó┌Įī┘ī¦ļŖ;ó█š¶s║═Ęųs;ó▄ō]░l(f©Ī)��Īó╔²╚A;ó▌╬³ĖĮ�Īó¹}╬÷�����ĪóØB╬÷;ó▐╚▄ĮŌ�Īó│▒ĮŌ;ó▀čµ╔½Ę┤æ¬����ĪŻ
(2)│ŻęŖ(ji©żn)Ą─╗»īW(xu©”)ūā╗»Ż║ó┘’L(f©źng)╗»�Īó┴“╗»���Īó└Ž╗»��Īó┴č╗»����ĪóŽ§╗»���ĪóŌg╗»���Īóė▓╗»����ĪóÜõ╗»�����Īó╦«╗»�����ĪóįĒ╗»����Īó╠┐╗»����Īó┤▀╗»�Īó§ź╗»�����Īó═¼╦ž«Éą╬¾wĄ─ŽÓ╗ź▐D╗»;ó┌├ō╦«;ó█Ė╔s��Īó▒¼š©;ó▄ļŖĮŌ��ĪóļŖÕā�ĪóļŖ╗»īW(xu©”)Ė»╬g����ĪóļŖĮŌ┘|(zh©¼)╚▄ę║ī¦ļŖ�ĪŻ
1.╝āā¶╬’║═╗ņ║Ž╬’Ą─▒╚▌^
╝āā¶╬’Ż║ėą╣╠Č©Ą─ĮM│╔║═ĮYśŗ�����Ż¼ėą╣╠Č©Ą─╚█����ĪóĘą³c(di©Żn)����Ż¼▒Ż│ųę╗ĘN╬’┘|(zh©¼)Ą─ąį┘|(zh©¼)
╗ņ║Ž╬’Ż║¤o(w©▓)╣╠Č©Ą─ĮM│╔║═ĮYśŗ���Ż¼¤o(w©▓)╣╠Č©Ą─╚█�ĪóĘą³c(di©Żn)����Ż¼▒Ż│ųįŁėą╬’┘|(zh©¼)Ė„ūįĄ─ąį┘|(zh©¼)
2.│ŻęŖ(ji©żn)Ą─╗ņ║Ž╬’
(1)ÜŌ¾w╗ņ║Ž╬’Ż║┐šÜŌ��Īó╦«├║ÜŌ(CO║═H2)��Īó▒¼°QÜŌ(H2║═O2)�Īó╠ņ╚╗ÜŌ(ų„ę¬│╔Ęų╩ŪCH4)����ĪóĮ╣ĀtÜŌ(ų„ę¬│╔Ęų╩ŪH2║═CH4)�ĪóĖ▀Āt├║ÜŌ�Īó╩»ė═ÜŌ�����Īó┴čĮŌÜŌ�ĪŻ
(2)ę║¾w╗ņ║Ž╬’Ż║░▒╦«�����Īó┬╚╦«�Īó═§╦«�����Īó╠ņ╚╗╦«�����Īóė▓╦«�Īó▄ø╦«���Īó╦«▓Ż┴¦�����ĪóĖŻĀ¢±R┴ų����ĪóØŌH2SO4��Īó¹}╦ß���ĪóŲ¹ė═����Īóų▓╬’ė═��Īó─z¾w�����ĪŻ
(3)╣╠¾w╗ņ║Ž╬’Ż║┤¾└Ē╩»����ĪóēA╩»╗ę�ĪóŲ»░ūĘ█�ĪóĖ▀Ęųūė╗»║Ž╬’�����Īó▓Ż┴¦�����Īó╦«─Ó���Īó║ŽĮ���ĪóõX¤ßä®����ĪŻ
1.╝āā¶╬’║═╗ņ║Ž╬’Ą─▒╚▌^ĘųŅÉ(l©©i)ś╦£╩▓╗═¼�����Ż¼╬’┘|(zh©¼)Ą─ŅÉ(l©©i)äe▓╗═¼
į┌╗»║Ž╬’ųą┐╔░┤ČÓĘNĘųŅÉ(l©©i)ś╦£╩ī”╬’┘|(zh©¼)▀M(j©¼n)ąąĘųŅÉ(l©©i)����Ż¼╚ń
░┤▓╗═¼Ą─ĘųŅÉ(l©©i)ś╦£╩
░┤╗»║Ž╬’Ą─ąį┘|(zh©¼)╦ß����ĪóēA���Īó¹}����Īóč§╗»╬’Ą╚
░┤╗»║Ž╬’ųą╗»īW(xu©”)µIĄ─ŅÉ(l©©i)äeļxūė╗»║Ž╬’��Īó╣▓ār(ji©ż)╗»║Ž╬’
░┤į┌╦«╚▄ę║╗“╚█╚┌ĀŅæB(t©żi)Ž┬╩Ūʱī¦ļŖļŖĮŌ┘|(zh©¼)��ĪóĘŪļŖĮŌ┘|(zh©¼)
Ęų╔óŽĄ�����Īó─z¾w
ę╗����Īóģ^Ęų╚²ĘNĘų╔óŽĄ
1.Ęų╔óŽĄ
░čę╗ĘN(╗“ČÓĘN)╬’┘|(zh©¼)Ęų╔óį┌┴Ēę╗ĘN(╗“ČÓĘN)╬’┘|(zh©¼)ųą╦∙Ą├ĄĮĄ─¾wŽĄ����ĪŻ
2.ĘųŅÉ(l©©i)
╚ńłD╦∙╩Š�����Ż¼░čĘų╔óŽĄĘų×ķ╚▄ę║����Īó─z¾w║═Øßę║Ą─ś╦£╩╩ŪĘų╔ó┘|(zh©¼)┴Żūėų▒ÅĮĄ─┤¾ąĪ��ĪŻŲõųą─z¾w┴Żūėų▒ÅĮĄ─┤¾ąĪ×ķ1Ī½100_nm�ĪŻ

3.╚²ĘNĘų╔óŽĄĄ─▒╚▌^

Č■���ĪóšŲ╬š─z¾wĄ─ąį┘|(zh©¼)╝░Fe(OH)3─z¾wĄ─ųŲéõ
1.─z¾wĄ─ąį┘|(zh©¼)╝░æ¬ė├
(1)ČĪ▀_Ā¢ą¦æ¬
┐╔ęŖ(ji©żn)╣Ō╩°═©▀^(gu©░)─z¾wĢr(sh©¬)��Ż¼Ģ■(hu©¼ )│÷¼Fę╗Śl╣Ō┴┴Ą─“═©┬Ę”¼FŽ¾����ĪŻ
æ¬ė├Ż║Ķbäe╚▄ę║║═─z¾w��ĪŻ
(2)Š█│┴
─z¾w┴ŻūėŠ█╝»│╔▌^┤¾Ņw┴Ż����Ż¼Å─Č°ą╬│╔│┴ĄĒÅ─Ęų╔óä®└’╬÷│÷Ą─▀^(gu©░)│╠Įąū„Š█│┴���ĪŻ
╩╣─z¾wŠ█│┴Ą─ĘĮĘ©ėąó┘╝ė╚ļļŖĮŌ┘|(zh©¼);ó┌╝ė╚ļ┼c─z┴ŻÄ¦ŽÓĘ┤ļŖ║╔Ą──z¾w;ó█╝ė¤ß�����ĪŻ
æ¬ė├Ż║╚²ĮŪų▐Ą─ą╬│╔;├„Ą\����ĪóĶF¹}╚▄ę║ā¶╦«;¹}¹uųŲČ╣Ė»��ĪŻ
2.Fe(OH)3─z¾wĄ─ųŲéõ
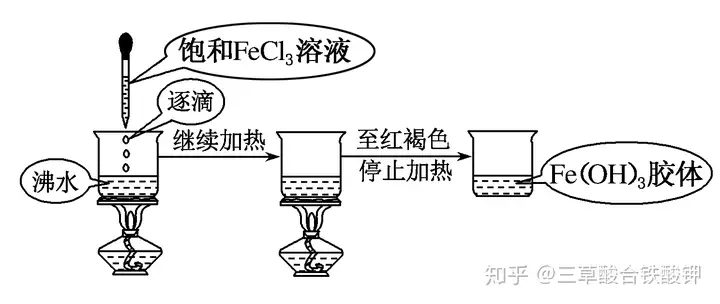
(1)Ę┤æ¬įŁ└ĒŻ║FeCl3+3H2OĪ„(=====)Fe(OH)3(─z¾w)+3HCl���ĪŻ
(2)▓┘ū„▓Į¾EŻ║Ž“Ęą╦«ųąųĄ╬╝ė╚ļ5Ī½6Ą╬FeCl3’¢║═╚▄ę║����Ż¼└^└mų¾Ęąų┴╚▄ę║│╩¼F╝t║ų╔½�ĪŻ
(3)ūóęŌ╩┬ĒŚ
ó┘╝ė¤ßų┴╚▄ę║│╩╝t║ų╔½║¾═Żų╣╝ė¤ß�ĪŻ
ó┌▓╗─▄ė├ūįüĒ(l©ói)╦«�Ż¼▓╗─▄öć░Ķ����ĪŻ
1.─z¾w▓╗ĦļŖ���Ż¼─z¾wųąĄ──z┴Ż─▄ē“╬³ĖĮ¾wŽĄųąĄ─ĦļŖļxūėČ°╩╣─z┴ŻÄ¦ļŖ║╔��Ż¼Ą½š¹éĆ(g©©)Ęų╔óŽĄ╚į│╩ļŖųąąį�ĪŻ
2.─z¾wųąĄ─Ęų╔ó┘|(zh©¼)╬ó┴Ż─▄═Ė▀^(gu©░)×V╝ł����Ż¼Ą½▓╗─▄═Ė▀^(gu©░)░ļ═Ė─ż��Ż¼ę“┤╦┐╔ė├▀^(gu©░)×VĄ─ĘĮĘ©Ęųļx─z¾w║═Øßę║����Ż¼ė├ØB╬÷Ą─ĘĮĘ©Ęųļx─z¾w║═╚▄ę║ųąĄ─Ęų╔ó┘|(zh©¼)��ĪŻ
3.Ģ°(sh©▒)īæ(xi©¦)ųŲéõFe(OH)3─z¾w╗»īW(xu©”)ĘĮ│╠╩ĮĄ─╦─éĆ(g©©)ęūÕe³c(di©Żn)
(1)ė├“=”
(2)Fe(OH)3Ęųūė╩Į║¾ūó├„─z¾wČ°▓╗╩╣ė├“↓”Ę¹╠¢�����ĪŻ
(3)Ę┤æ¬Śl╝■╩Ū“Ī„”����ĪŻ
(4)HCl║¾▓╗─▄ś╦“↑”Ę¹╠¢��ĪŻ
ļxūėĘ┤æ¬
ļŖĮŌ┘|(zh©¼)╝░ŲõļŖļx
1.ļŖĮŌ┘|(zh©¼)║═ĘŪļŖĮŌ┘|(zh©¼)
(1)ļŖĮŌ┘|(zh©¼)Ż║į┌╦«╚▄ę║└’╗“╚█╚┌ĀŅæB(t©żi)Ž┬─▄ē“ī¦ļŖĄ─╗»║Ž╬’��ĪŻ
(2)ĘŪļŖĮŌ┘|(zh©¼)Ż║į┌╦«╚▄ę║└’ęį╝░╚█╚┌ĀŅæB(t©żi)Ž┬Č╝▓╗─▄ī¦ļŖĄ─╗»║Ž╬’��ĪŻ
2.ÅŖļŖĮŌ┘|(zh©¼)║═╚§ļŖĮŌ┘|(zh©¼)
(1)ÅŖļŖĮŌ┘|(zh©¼)Ż║į┌╦«╚▄ę║ųą─▄═Ļ╚½ļŖļxĄ─ļŖĮŌ┘|(zh©¼)����ĪŻ
(2)╚§ļŖĮŌ┘|(zh©¼)Ż║į┌╦«╚▄ę║ųą▓┐ĘųļŖļxĄ─ļŖĮŌ┘|(zh©¼)���ĪŻ
3.ļŖļx╝░ļŖļxĘĮ│╠╩Į
(1)ļŖļxŻ║ļŖĮŌ┘|(zh©¼)į┌╦«╚▄ę║ųą╗“╚█╚┌ĀŅæB(t©żi)Ž┬«a(ch©Żn)╔·ūįė╔ęŲäė(d©░ng)ļxūėĄ─▀^(gu©░)│╠��Ż¼ļŖļx▀^(gu©░)│╠┐╔ęįė├ļŖļxĘĮ│╠╩Į▒Ē╩Š�ĪŻ
(2)ļŖļxĘĮ│╠╩Į
ó┘ÅŖļŖĮŌ┘|(zh©¼)Ż║═Ļ╚½ļŖļx�����Ż¼ė├“=”▒Ē╩Š���ĪŻ
└²╚ńNaCl===Na++Cl-��ĪŻ
ó┌╚§ļŖĮŌ┘|(zh©¼)Ż║▓┐ĘųļŖļx����Ż¼ė├“┐╔─µĘ¹╠¢”▒Ē╩Š����ĪŻ
└²╚ńNH3·H2O??NH4(+)+OH-��ĪŻ
ó█ČÓį¬╚§╦ßĘų▓ĮļŖļx����Ż¼ę╗░ŃęįĄ┌ę╗▓ĮļŖļx×ķų„�ĪŻ
└²╚ńH2CO3??H++HCO3(-)�����ĪŻ
ó▄ČÓį¬╚§ēAę▓Ęų▓ĮļŖļx�����Ż¼Ą½ę╗▓Įīæ(xi©¦)═Ļ���ĪŻ
└²╚ńFe(OH)3??Fe3++3OH-�ĪŻ
ę╗ĘNĻP(gu©Īn)ŽĄ
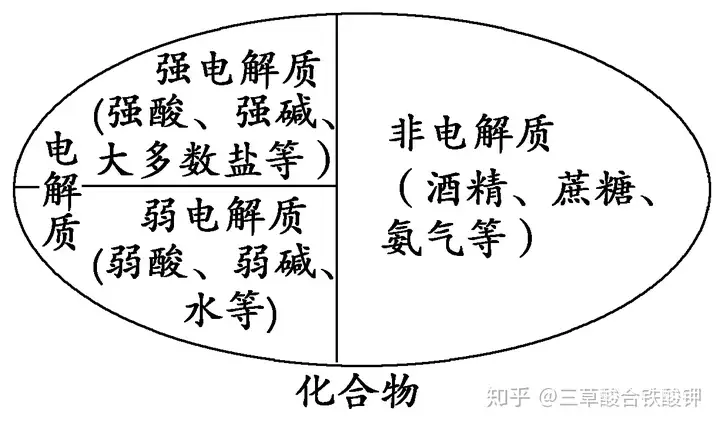
ļŖĮŌ┘|(zh©¼)�ĪóĘŪļŖĮŌ┘|(zh©¼)�ĪóÅŖļŖĮŌ┘|(zh©¼)���Īó╚§ļŖĮŌ┘|(zh©¼)ų«ķgĄ─ĻP(gu©Īn)ŽĄ
ļŖĮŌ┘|(zh©¼)Ą─╔Ņ╗»═žš╣
1.ļŖĮŌ┘|(zh©¼)▓╗ę╗Č©─▄ī¦ļŖ���Ż¼╚ń╣╠æB(t©żi)NaCl��Īóę║æB(t©żi)HClĄ╚;─▄ī¦ļŖĄ─╬’┘|(zh©¼)▓╗ę╗Č©╩ŪļŖĮŌ┘|(zh©¼)����Ż¼╚ńĶF�ĪóõXĄ╚Įī┘å╬┘|(zh©¼)����ĪŻ
2.ĘŪļŖĮŌ┘|(zh©¼)▓╗ī¦ļŖ����Ż¼Ą½▓╗ī¦ļŖĄ─╬’┘|(zh©¼)▓╗ę╗Č©╩ŪĘŪļŖĮŌ┘|(zh©¼)��Ż¼╚ńĮäé╩»�����Īóå╬┘|(zh©¼)┴“Ą╚ę╗ą®ĘŪĮī┘å╬┘|(zh©¼)�����ĪŻ
3.ļŖĮŌ┘|(zh©¼)║═ĘŪļŖĮŌ┘|(zh©¼)Č╝╩Ū╗»║Ž╬’�Ż¼å╬┘|(zh©¼)║═╗ņ║Ž╬’╝╚▓╗╩ŪļŖĮŌ┘|(zh©¼)ę▓▓╗╩ŪĘŪļŖĮŌ┘|(zh©¼)�ĪŻ
4.ļŖĮŌ┘|(zh©¼)ę╗Č©╩ŪųĖūį╔ĒļŖļx╔·│╔ļxūėĄ─╗»║Ž╬’���Ż¼ėąą®╗»║Ž╬’Ą─╦«╚▄ę║─▄ī¦ļŖ��Ż¼Ą½╚▄ę║ųąĄ─ļxūė▓╗╩Ū╦³ūį╔ĒļŖļx«a(ch©Żn)╔·Ą─�Ż¼▓╗ī┘ė┌ļŖĮŌ┘|(zh©¼)�����Ż¼╚ńCO2�ĪóSO2�ĪóNH3�����ĪóSO3Ą╚ĘŪļŖĮŌ┘|(zh©¼)��Ż¼╦³éā┼c╦«Ę┤æ¬╔·│╔Ą─«a(ch©Żn)╬’H2CO3�����ĪóH2SO3�ĪóNH3·H2O����ĪóH2SO4ūį╔Ē─▄ļŖļx�Ż¼╩ŪļŖĮŌ┘|(zh©¼)��ĪŻ
ļŖļxĘĮ│╠╩ĮĢ°(sh©▒)īæ(xi©¦)“╚²įŁät”
(1)Ę¹║Ž┐═ė^(gu©Īn)╩┬īŹ(sh©¬)�Ż¼▓╗─▄ļSęŌĢ°(sh©▒)īæ(xi©¦)�����ĪŻļxūėĘ¹╠¢║═įŁūėłFĄ─▓╗┐╔▓Ęųąį(ūóęŌŻ║NaHSO4į┌╦«ųą═Ļ╚½ļŖļx����Ż¼╔·│╔Na+�����ĪóH+����ĪóSO4(2-))��ĪŻ
(2)┘|(zh©¼)┴┐╩ž║Ń
“=”ū¾ėęā╔▀ģįŁūėĘNŅÉ(l©©i)����ĪóöĄ─┐▓╗ūā�����ĪŻ
(3)ļŖ║╔╩ž║Ń
ļŖļxĘĮ│╠╩Į“=”ū¾ėęā╔▀ģĄ─ļŖ║╔┐éöĄŽÓĄ╚�ĪŻ
ļxūėĘ┤æ¬ĪĪļxūėĘĮ│╠╩Į
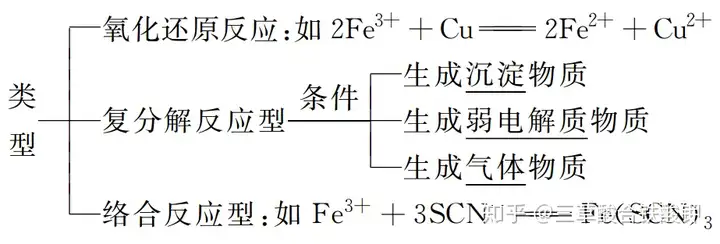
1.ļxūėĘ┤æ¬
(1)Ė┼─ŅŻ║ėąļxūėģó╝ė╗“╔·│╔Ą─╗»īW(xu©”)Ę┤æ¬�����ĪŻ
(2)ļxūėĘ┤æ¬Ą─ŅÉ(l©©i)ą═
2.ļxūėĘĮ│╠╩Į
(1)ęŌ┴xŻ║▓╗āH▒Ē╩Š─│ę╗éĆ(g©©)Š▀¾wĄ─╗»īW(xu©”)Ę┤æ¬�Ż¼▀Ć▒Ē╩Š═¼ę╗ŅÉ(l©©i)ą═Ą─ļxūėĘ┤æ¬�Ż¼╚ńÜõč§╗»Ōc╚▄ę║║═¹}╦ßĘ┤æ¬����ĪóÜõč§╗»Ō}╚▄ę║║═Ž§╦ßĘ┤æ¬Ą─ļxūėĘĮ│╠╩Į��Ż¼Č╝┐╔ė├ļxūėĘĮ│╠╩ĮH++OH-===H2OüĒ(l©ói)▒Ē╩Š��ĪŻ
(2)Ģ°(sh©▒)īæ(xi©¦)▓Į¾EŻ║ęįCaCO3┼c¹}╦ߥ─Ę┤æ¬×ķ└²���ĪŻ
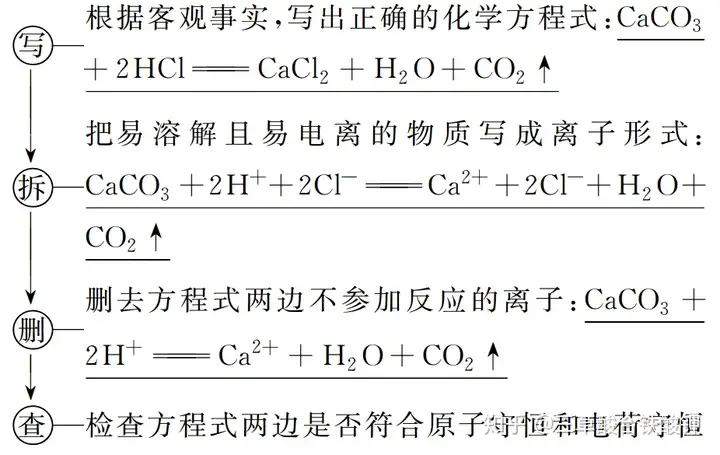
ļxūėĘĮ│╠╩Įš²š`┼ąöÓĄ─īÅŅ}ę¬³c(di©Żn)

“┴┐▒╚”Ž▌┌Õ
į┌ļxūėĘĮ│╠╩Įš²š`┼ąöÓųą��Ż¼īW(xu©”)╔·═∙═∙║÷┬įŽÓī”┴┐Ą─ė░Ēæ�Ż¼├³Ņ}š▀═∙═∙įOų├“ļxūėĘĮ│╠╩Į«a(ch©Żn)╬’š²┤_����Ż¼Ą½▓╗Ę¹║ŽŽÓī”┴┐”Ą─Ž▌┌Õ���ĪŻ═╗ŲŲ“Ž▌┌Õ”Ą─ĘĮĘ©ę╗╩ŪīÅ£╩“ŽÓī”┴┐”Ą─ČÓ╔┘�����ĪŻ
┼c“┴┐”ėąĻP(gu©Īn)Ą─ļxūėĘĮ│╠╩ĮĄ─Ģ°(sh©▒)īæ(xi©¦)
1.▀B└mĘ┤æ¬ą═ļxūėĘ┤æ¬
Ę┤æ¬╔·│╔Ą─ļxūėę“ėų─▄Ė·╩ŻėÓ(▀^(gu©░)┴┐)Ą─Ę┤æ¬╬’└^└mĘ┤æ¬Č°Ė·ė├┴┐ėąĻP(gu©Īn)�ĪŻ╚ńŻ║OH-═©╚ļCO2(©D©D→)CO3(2-)CO2(©D©D→)HCO3(-);Al3+OH-(©D©D→)Al(OH)3OH-(©D©D→)AlO2(-);AlO2(-)H+(©D©D→)Al(OH)3H+(©D©D→)Al3+;FeÅŖč§╗»ä®(©D©D→)Fe3+Fe(©D©D→)Fe2+����ĪŻ
2.Ž╚║¾ą═ļxūėĘ┤æ¬
ę╗ĘNĘ┤æ¬╬’ųąā╔ĘN╗“ā╔ĘNęį╔ŽĄ─ļxūėČ╝─▄Ė·┴Ēę╗ĘNĘ┤æ¬╬’Ę┤æ¬���Ż¼«a(ch©Żn)╬’ę“Ę┤æ¬┤╬ą“ęį╝░Ę┤æ¬╬’Ą─┴┐ėąĻP(gu©Īn)�Ż¼╚ńFeBr2┼cCl2Ę┤æ¬����ĪŻ
3.┼õ▒╚ą═ļxūėĘ┤æ¬
ā╔ĘNĘ┤æ¬╬’Ę┤æ¬Ģr(sh©¬)�����Ż¼Ę┤æ¬╬’ųąėąā╔ĘN╗“ā╔ĘNęį╔ŽļxūėĘ┤æ¬Ģr(sh©¬)��Ż¼«öę╗ĘNĮM│╔ļxūėŪĪ║├═Ļ╚½Ę┤æ¬Ģr(sh©¬)����Ż¼┴Ēę╗ĘNĮM│╔ļxūė▓╗─▄ŪĪ║├═Ļ╚½Ę┤æ¬(ėą╩ŻėÓ╗“▓╗ūŃ)�Ż¼«a(ch©Żn)╬’┼cĘ┤æ¬╬’Ą─ė├┴┐ėąĻP(gu©Īn)����Ż¼╚ńCa(OH)2┼cNaHCO3Ę┤æ¬����ĪŻ
▀B└mą═ļxūėĘĮ│╠╩ĮĄ─Ģ°(sh©▒)īæ(xi©¦)ĘĮĘ©
Ė∙ō■Ę┤æ¬Śl╝■Ž╚Ęų╬÷Ę┤æ¬╬’╩Ūʱ┤µį┌▀^(gu©░)┴┐�����Ż¼į┘Ė∙ō■Ę┤æ¬įŁ└ĒĢ°(sh©▒)īæ(xi©¦)�����ĪŻ╚¶¤o(w©▓)▀^(gu©░)┴┐���Ż¼ät░l(f©Ī)╔·Ą┌ę╗▓ĮĘ┤æ¬����Ż¼╚¶▀^(gu©░)┴┐���Ż¼ätĘ┤æ¬╬’░l(f©Ī)╔·ā╔▓ĮĘ┤æ¬�����Ż¼īæ(xi©¦)ļxūėĘĮ│╠╩ĮĢr(sh©¬)ät▓╗▒žīæ(xi©¦)│÷Ą┌ę╗▓ĮĘ┤æ¬Ą─ųąķg«a(ch©Żn)╬’�����Ż¼░┤ĮKæB(t©żi)«a(ch©Żn)╬’īæ(xi©¦)ļxūėĘ┤æ¬ĘĮ│╠╩Į����ĪŻ╚ńČÓį¬╚§╦ß╗“╦߶¹(╚ńCO2╗“SO2)┼cÅŖēA╚▄ę║Ę┤æ¬����Ż¼╚¶CO2(╗“SO2)╔┘┴┐���Ż¼«a(ch©Żn)╬’×ķš²¹};╚¶CO2(╗“SO2)▀^(gu©░)┴┐���Ż¼«a(ch©Żn)╬’×ķ╦ß╩Į¹};ČÓį¬╚§╦ßš²¹}┼cÅŖ╦ßĘ┤æ¬����Ż¼Ž╚╔·│╔╦ß╩Į¹}���Ż¼╦ß╩Į¹}į┘▀M(j©¼n)ę╗▓Į┼c╦ßĘ┤æ¬�Ż¼╔·│╔ÅŖ╦ß¹}║═╚§╦ß�����ĪŻ
Ž╚║¾ą═ļxūėĘ┤æ¬ĘĮ│╠╩ĮĄ─Ģ°(sh©▒)īæ(xi©¦)ĘĮĘ©
(1)Å═ĘųĮŌĘ┤æ¬ą═Ż║ę└ō■“ĖéĀÄĘ┤æ¬�ĪóÅŖš▀ā×(y©Łu)Ž╚”Ą─ęÄ┬╔├„┤_ļxūėĘ┤æ¬Ą─Ž╚║¾Ēśą“��Ż¼į┘░┤Ę┤æ¬įŁ└ĒĢ°(sh©▒)īæ(xi©¦)���Ż¼╚ńŽ“║¼ėąOH-�����ĪóCO3(2-)���ĪóAlO2(-)Ą─╚▄ę║ųą���Ż¼ųĄ╬╝ė╚ļŽĪ¹}╦ßų┴▀^(gu©░)┴┐�Ż¼ę“ĮY║Ž┘|(zh©¼)ūėĄ──▄┴”OH->AlO2(-)>CO3(2-)����Ż¼ätĘ┤æ¬Ą─ļxūėĘĮ│╠╩Įę└┤╬×ķOH-+H+===H2O����ĪóAlO2(-)+H++H2O===Al(OH)3↓����ĪóCO3(2-)+2H+===H2O+CO2↑���ĪóAl(OH)3+3H+===Al3++3H2O���ĪŻ
(2)č§╗»▀ĆįŁą═Ż║ó┘ÅŖč§╗»ä®ė÷ĄĮā╔ĘN▀ĆįŁąįļxūėĢr(sh©¬)�Ż¼æ¬ūóęŌč§╗»ä®╩Ūʱ▀^(gu©░)┴┐���Ż¼╚¶č§╗»ä®▓╗ūŃ��Ż¼īó▀ĆįŁąįļxūė░┤▀ĆįŁąįÅŖ╚§┼┼ą“����Ż¼šl(shu©¬)ÅŖšl(shu©¬)Ž╚Ę┤æ¬����ĪŻ╚ńīó╔┘┴┐Ą─Cl2═©╚ļFeBr2╚▄ę║ųą�����Ż¼ļxūėĘĮ│╠╩Į×ķ2Fe2++Cl2===2Fe3++2Cl-;╚¶Cl2▀^(gu©░)┴┐��Ż¼ätļxūėĘĮ│╠╩Į×ķ2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-��ĪŻó┌į┌▓╗├„┤_ļxūėĘ┤æ¬Ą─Ž╚║¾Ēśą“Ģr(sh©¬)���Ż¼┐╔ė├╝┘įOČ©ą“Ę©���Ż¼╚ńFeBr2╚▄ę║┼cCl2Ę┤æ¬����Ż¼┐╔╝┘įOCl2Ž╚┼cBr-Ę┤æ¬��Ż¼ät╔·│╔Ą─õÕå╬┘|(zh©¼)▀Ćę¬č§╗»Fe2+╔·│╔Fe3+�Ż¼▀@śė╝┤┐╔┤_Č©Cl2Ž╚┼cFe2+║¾┼cBr-Ę┤æ¬��Ż¼╚╗║¾į┘Ė∙ō■┴┐Ą─ĻP(gu©Īn)ŽĄĢ°(sh©▒)īæ(xi©¦)╝┤┐╔���ĪŻ
┼õ▒╚ą═ļxūėĘ┤æ¬ĘĮ│╠╩ĮĄ─Ģ°(sh©▒)īæ(xi©¦)ĘĮĘ©
┼õ▒╚ą═ļxūėĘ┤æ¬░┤šš“ęį╔┘Č©ČÓ”Ą─įŁät▀M(j©¼n)ąąĢ°(sh©▒)īæ(xi©¦)����Ż¼╝┤Ž╚Ė∙ō■Ņ}ĮoŚl╝■┼ąöÓ“╔┘┴┐╬’┘|(zh©¼)”���Ż¼ęį╔┘┴┐╬’┘|(zh©¼)Ą─ļxūėėŗ┴┐öĄ(│õĘųĘ┤æ¬)┤_Č©╦∙ąĶ“▀^(gu©░)┴┐╬’┘|(zh©¼)”Ą─ļxūėöĄ─┐��ĪŻ╚ńŽ“Ca(HCO3)2╚▄ę║ųą╝ė╚ļ▀^(gu©░)┴┐NaOH╚▄ę║Ą─ļxūėĘĮ│╠╩ĮĄ─Ģ°(sh©▒)īæ(xi©¦)ĘĮĘ©×ķ
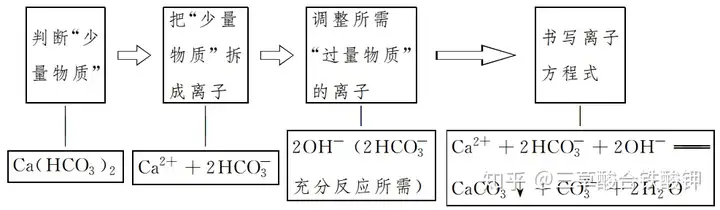
ļxūė╣▓┤µ
ę╗�����Īóļxūė╣▓┤µĄ─▒Š┘|(zh©¼)
ÄūĘNļxūėį┌═¼ę╗╚▄ę║ųą─▄┤¾┴┐╣▓┤µ����Ż¼Š═╩ŪųĖļxūėų«ķg▓╗░l(f©Ī)╔·╚╬║╬Ę┤æ¬;╚¶ļxūėų«ķg─▄░l(f©Ī)╔·Ę┤æ¬��Ż¼ät▓╗─▄┤¾┴┐╣▓┤µ����ĪŻ
Č■�Īóļxūė▓╗─▄┤¾┴┐╣▓┤µĄ─╦─ĘNŅÉ(l©©i)ą═
1.Å═ĘųĮŌĘ┤æ¬ą═
(1)╔·│╔ļy╚▄╬’╗“╬ó╚▄╬’Ą─ļxūė▓╗─▄┤¾┴┐╣▓┤µ
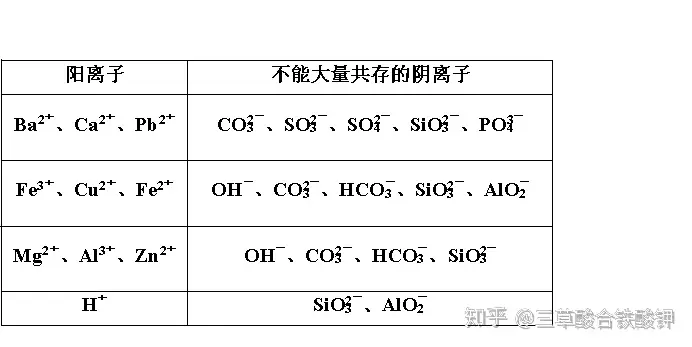
(2)╔·│╔ÜŌ¾w╝░ō]░l(f©Ī)ąį╬’┘|(zh©¼)Ą─ļxūė▓╗─▄┤¾┴┐╣▓┤µ

(3)╔·│╔ļyļŖļx╬’┘|(zh©¼)(╦«���Īó╚§╦ß����Īóę╗╦«║Ž░▒Ą╚)Ą─ļxūė▓╗─▄┤¾┴┐╣▓┤µ
ó┘H+┼cCH3COO-�ĪóCO3(2-)���ĪóS2-���ĪóSO3(2-)Ą╚╔·│╔╚§╦ß▓╗─▄┤¾┴┐╣▓┤µ���ĪŻ
ó┌OH-┼cNH4(+)(ŽĪ╚▄ę║)╔·│╔╚§ēA▓╗─▄┤¾┴┐╣▓┤µ�ĪŻ
ó█H+┼cOH-╔·│╔╦«▓╗─▄┤¾┴┐╣▓┤µ�ĪŻ
ó▄ČÓį¬╚§╦ߥ─╦ß╩Į╦ßĖ∙ļxūė(╚ńHCO3(-)�ĪóHSO3(-)�����ĪóHS-���ĪóH2PO4(-)���ĪóHPO4(2-)Ą╚)┼cH+���ĪóOH-Š∙▓╗─▄┤¾┴┐╣▓┤µ����ĪŻ
2.č§╗»▀ĆįŁĘ┤æ¬ą═
Š▀ėą▌^ÅŖč§╗»ąįĄ─ļxūė┼cŠ▀ėą▌^ÅŖ▀ĆįŁąįļxūė����Ż¼Ģ■(hu©¼ )░l(f©Ī)╔·č§╗»▀ĆįŁĘ┤æ¬Č°▓╗─▄┤¾┴┐╣▓┤µ��ĪŻ(3)╔·│╔ļyļŖļx╬’┘|(zh©¼)(╦«���Īó╚§╦ß��Īóę╗╦«║Ž░▒Ą╚)Ą─ļxūė▓╗─▄┤¾┴┐╣▓┤µ
ó┘H+┼cCH3COO-��ĪóCO3(2-)�ĪóS2-���ĪóSO3(2-)Ą╚╔·│╔╚§╦ß▓╗─▄┤¾┴┐╣▓┤µ�ĪŻ
ó┌OH-┼cNH4(+)(ŽĪ╚▄ę║)╔·│╔╚§ēA▓╗─▄┤¾┴┐╣▓┤µ����ĪŻ
ó█H+┼cOH-╔·│╔╦«▓╗─▄┤¾┴┐╣▓┤µ�����ĪŻ
ó▄ČÓį¬╚§╦ߥ─╦ß╩Į╦ßĖ∙ļxūė(╚ńHCO3(-)���ĪóHSO3(-)���ĪóHS-���ĪóH2PO4(-)����ĪóHPO4(2-)Ą╚)┼cH+�ĪóOH-Š∙▓╗─▄┤¾┴┐╣▓┤µ�ĪŻ
2.č§╗»▀ĆįŁĘ┤æ¬ą═
Š▀ėą▌^ÅŖč§╗»ąįĄ─ļxūė┼cŠ▀ėą▌^ÅŖ▀ĆįŁąįļxūė��Ż¼Ģ■(hu©¼ )░l(f©Ī)╔·č§╗»▀ĆįŁĘ┤æ¬Č°▓╗─▄┤¾┴┐╣▓┤µ�ĪŻ

3.╦«ĮŌŽÓ╗ź┤┘▀M(j©¼n)ą═
«ö╚§╦ߥ─╦ßĖ∙┼c╚§ēAĄ─Ļ¢(y©óng)ļxūė═¼Ģr(sh©¬)┤µį┌ė┌╦«╚▄ę║ųąĢr(sh©¬)����Ż¼╚§╦ߥ─╦ßĖ∙╦«ĮŌ╔·│╔Ą─OH-┼c╚§ēAĄ─Ļ¢(y©óng)ļxūė╦«ĮŌ╔·│╔Ą─H+Ę┤æ¬╔·│╔╦«���Ż¼Å─Č°╩╣ā╔ĘNļxūėĄ─╦«ĮŌ╗źŽÓ┤┘▀M(j©¼n)Č°╩╣ŲĮ║ŌŽ“╦«ĮŌĘĮŽ“ęŲäė(d©░ng)����Ż¼╔§ų┴═Ļ╚½Ę┤æ¬�ĪŻ╚ńAl3+┼cCO3(2-)▓╗─▄╣▓┤µ�ĪŻ
2Al(OH)3↓+3CO2↑(+3H2O===)+OH-CO3(2-)+H2O??HCO3(-)│ŻęŖ(ji©żn)Ą─ę“░l(f©Ī)╔·ŽÓ╗ź┤┘▀M(j©¼n)Ą─╦«ĮŌĘ┤æ¬Č°▓╗─▄┤¾┴┐╣▓┤µĄ─ļxūė╚ńŽ┬Ż║
(1)Al3+┼cCO3(2-)��ĪóHCO3(-)���ĪóS2-��ĪóHS-��ĪóAlO2(-)���ĪóSiO3(2-)���ĪŻ
(2)Fe3+┼cCO3(2-)��ĪóHCO3(-)�ĪóAlO2(-)����ĪóSiO3(2-)���ĪŻ
4.Įj(lu©░ )║ŽĘ┤æ¬ą═
ļxūėķgę“░l(f©Ī)╔·Įj(lu©░ )║ŽĘ┤æ¬Č°▓╗─▄┤¾┴┐╣▓┤µ����Ż¼ųąīW(xu©”)│ŻęŖ(ji©żn)Ą─Ę┤æ¬ėą
(1)Fe3+┼cSCN-ę“╔·│╔Fe(SCN)3Č°▓╗─▄┤¾┴┐╣▓┤µ����ĪŻ
(2)Ag+┼cNH3·H2Oę“╔·│╔[Ag(NH3)2]+Č°▓╗─▄┤¾┴┐╣▓┤µ����ĪŻ
(3)Cu2+┼cNH3·H2Oę“╔·│╔[Cu(NH3)4]2+Č°▓╗─▄┤¾┴┐╣▓┤µ���ĪŻ
(4)Zn2+┼cNH3·H2Oę“╔·│╔[Zn(NH3)4]2+Č°▓╗─▄┤¾┴┐╣▓┤µ�����ĪŻ
ūóęŌŻ║ĮŌ┤ļxūė╣▓┤µŅÉ(l©©i)Ņ}─┐Ģr(sh©¬)�����Ż¼│²┴╦ĘŪ│Ż╩ņŽżļxūė▓╗─▄┤¾┴┐╣▓┤µĄ─╦─┤¾Ę┤æ¬ŅÉ(l©©i)ą══Ō���Ż¼▀Ćę¬╠žäeūóęŌŅ}─┐ųąĄ─ļ[║¼Śl╝■��Ż¼Å─Č°┐ņ╦┘£╩┤_ŲŲĮŌļxūė╣▓┤µŅ}�����ĪŻ
č§╗»▀ĆįŁĘ┤æ¬
č§╗»▀ĆįŁĘ┤æ¬╝░ŲõŽÓĻP(gu©Īn)Ė┼─Ņ
ę╗�Īóč§╗»▀ĆįŁĘ┤æ¬
1.Ė┼─Ņ
─│ą®╬’┘|(zh©¼)▒╗č§╗»���Ż¼═¼Ģr(sh©¬)─│ą®╬’┘|(zh©¼)▒╗▀ĆįŁĄ─Ę┤æ¬�ĪŻ
2.╠žš„
ėąį¬╦ž╗»║Žār(ji©ż)ūā╗»(┼ąöÓę└ō■)����ĪŻ
3.▒Š┘|(zh©¼)
ļŖūė▐DęŲ(░³└©ļŖūėĄ─Ą├╩¦����Īó╣▓ė├ļŖūėī”Ą─Ų½ęŲ)��ĪŻ
4.ĻP(gu©Īn)ŽĄ
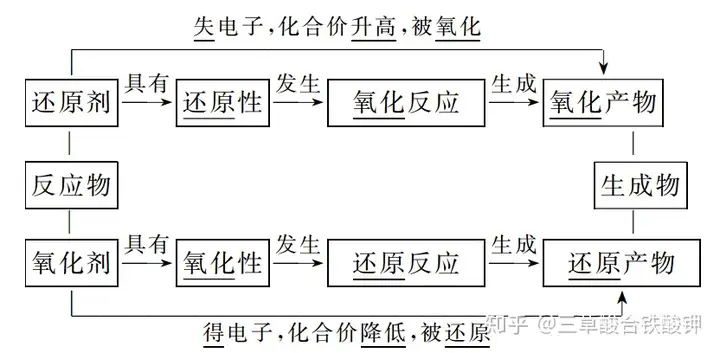
└²╚ńī”ė┌Ę┤æ¬MnO2+4HCl(ØŌ)Ī„(=====)MnCl2+Cl2↑+2H2O
ó┘MnO2į┌Ę┤æ¬ųąĄ├ĄĮļŖūė�Ż¼╦∙║¼į¬╦žĄ─╗»║Žār(ji©ż)ĮĄĄ═�����Ż¼▒╗▀ĆįŁ����Ż¼░l(f©Ī)╔·▀ĆįŁĘ┤æ¬���Ż¼ū„č§╗»ä®����ĪŻ
ó┌HClį┌Ę┤æ¬ųą╩¦╚źļŖūė�����Ż¼╦∙║¼į¬╦žĄ─╗»║Žār(ji©ż)╔²Ė▀�����Ż¼▒╗č§╗»��Ż¼░l(f©Ī)╔·č§╗»Ę┤æ¬��Ż¼ū„▀ĆįŁä®�����ĪŻ
5.č§╗»▀ĆįŁĘ┤æ¬┼c╦─ĘN╗∙▒ŠĘ┤æ¬ŅÉ(l©©i)ą═Ą─ĻP(gu©Īn)ŽĄ
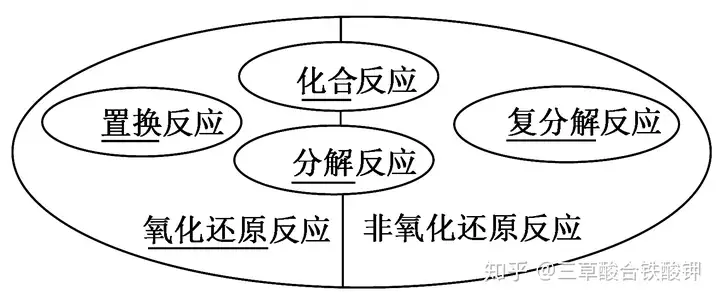
Č■��Īó│ŻęŖ(ji©żn)Ą─č§╗»ä®║═▀ĆįŁä®
1.│ŻęŖ(ji©żn)Ą─č§╗»ä®
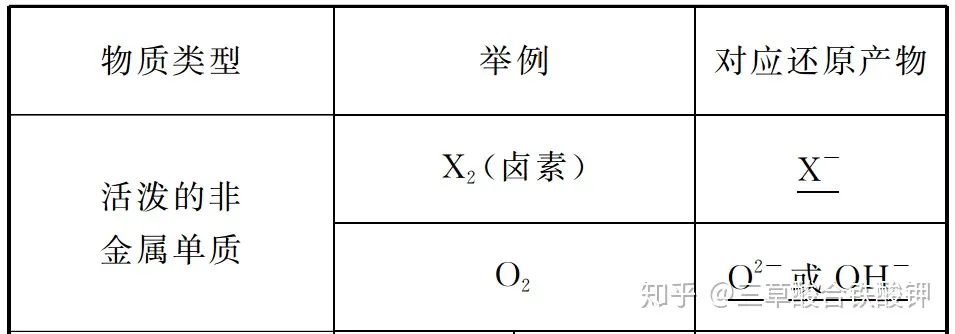
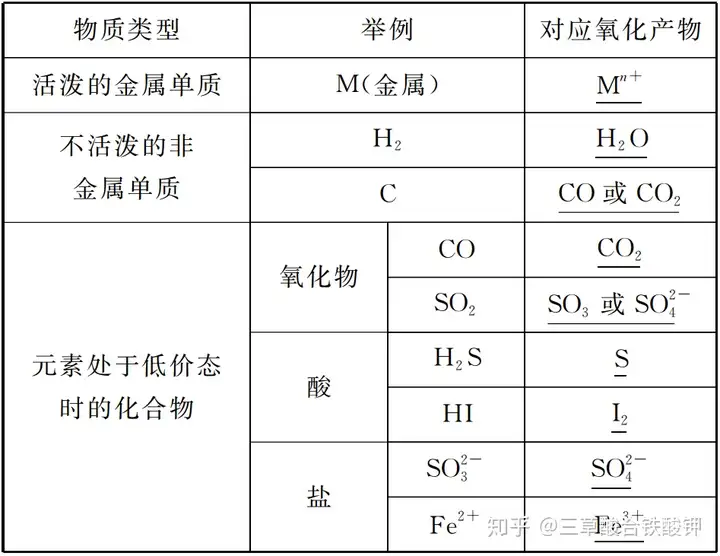
2.│ŻęŖ(ji©żn)Ą─▀ĆįŁä®
1.č§╗»▀ĆįŁĘ┤æ¬Ė┼─ŅķgĄ─ĻP(gu©Īn)ŽĄŻ║╩ņėø┴∙éĆ(g©©)ūųŻ║“╔²��Īó╩¦�Īóč§;ĮĄ����ĪóĄ├�����Īó▀Ć”[į¬╦ž╗»║Žār(ji©ż)╔²Ė▀(ĮĄĄ═)�����Īó╩¦(Ą├)ļŖūė�Ż¼░l(f©Ī)╔·č§╗»(▀ĆįŁ)Ę┤æ¬]���ĪŻ
2.╩ņėø│ŻęŖ(ji©żn)į¬╦žĄ─╗»║Žār(ji©ż)Ż║ę╗ār(ji©ż)Üõ����ĪóŌø�ĪóŌc�ĪóĘ·����Īó┬╚����ĪóõÕ��ĪóĄŌ���ĪóŃy;Č■ār(ji©ż)č§�����ĪóŌ}��Īóõ^��ĪóµV�Īóõ\;╚²õX���Īó╦─╣Ķ��Īó╬Õār(ji©ż)┴ū;šf(shu©Ł)ūāār(ji©ż)ę▓▓╗ļy���Ż¼Č■╚²ĶF�����ĪóČ■╦─╠╝�����ĪóČ■╦─┴∙┴“Č╝²R╚½;Ń~╣»Č■ār(ji©ż)ūŅ│ŻęŖ(ji©żn)�ĪŻ
3.ėąå╬┘|(zh©¼)ģó┼c╗“╔·│╔Ą─Ę┤æ¬▓╗ę╗Č©ī┘ė┌č§╗»▀ĆįŁĘ┤æ¬���Ż¼╚ń3O2Ę┼ļŖ(=====)2O3�����ĪŻ
4.└╬ėøę╗ą®╠ž╩Ō╬’┘|(zh©¼)ųąį¬╦žĄ─╗»║Žār(ji©ż)(å╬╬╗Ż║ār(ji©ż))
CuFeS2Ż║Cu +2Fe +2S -2
K2FeO4Ż║Fe +6Li2NH���ĪóLiNH2���ĪóAlNŻ║N -3
Na2S2O3Ż║S +2MO2(+)Ż║M +5
C2O4(2-)Ż║C +3HCNŻ║C +2N -3
CuHŻ║Cu +1H -1
FeO4(n-)Ż║Fe +(8-n)Si3N4Ż║Si +4N -3
╚²éĆ(g©©)š`ģ^
1.šJ×ķč§╗»ąį║═▀ĆįŁąįĄ─ÅŖ╚§╚ĪøQė┌Ą├╩¦ļŖūėĄ─ČÓ╔┘
č§╗»ąį║═▀ĆįŁąįĄ─ÅŖ╚§ų╗╚ĪøQė┌ļŖūėĄ├╩¦Ą─ļyęū�Ż¼Č°┼cļŖūėĄ├╩¦Ą─ČÓ╔┘¤o(w©▓)ĻP(gu©Īn)�����ĪŻ
╚ń├┐─”Ā¢ØŌŽ§╦ß▀ĆįŁ×ķNO2Ģr(sh©¬)Ą├ĄĮ1 molļŖūė����Ż¼├┐─”Ā¢ŽĪŽ§╦ß▀ĆįŁ×ķNOĢr(sh©¬)Ą├ĄĮ3 molļŖūė�Ż¼Ą½ØŌŽ§╦ߥ─č§╗»ąįģs▒╚ŽĪŽ§╦ßÅŖ��ĪŻ
2.šJ×ķų╗ę¬į¬╦ž╗»║Žār(ji©ż)┤µį┌▓Ņ«ÉŠ═┐╔░l(f©Ī)╔·č§╗»▀ĆįŁĘ┤æ¬
═¼ĘNį¬╦ž▓╗═¼ār(ji©ż)æB(t©żi)Ą─╗»║Ž╬’ķgĄ─č§╗»▀ĆįŁĘ┤æ¬ū±čŁęįŽ┬ęÄ┬╔Ż║
(1)ŽÓÓÅār(ji©ż)æB(t©żi)ų«ķg▓╗░l(f©Ī)╔·č§╗»▀ĆįŁĘ┤æ¬�����ĪŻ╚ńSO2║═ØŌ┴“╦ß▓╗Ę┤æ¬�����ĪŻ
(2)ŽÓķgār(ji©ż)æB(t©żi)����Ż¼į┌ę╗Č©Śl╝■Ž┬─▄░l(f©Ī)╔·Ę┤æ¬╔·│╔ųąķgār(ji©ż)æB(t©żi)�ĪŻ╚ń2FeCl3+Fe===3FeCl2����ĪŻ
3.šJ×ķ═¼ĘNį¬╦ž▓╗═¼ār(ji©ż)æB(t©żi)Ą─╗»║Ž╬’Ą─č§╗»ąį(▀ĆįŁąį)ÅŖ╚§ų╗┼cį¬╦ž╗»║Žār(ji©ż)Ą─Ė▀Ą═ėąĻP(gu©Īn)
īŹ(sh©¬)ļH╔Ž�����Ż¼│²┤╦ų«═Ō▀Ć┼c╗»║Ž╬’Ą─ĘĆČ©ąįėąĻP(gu©Īn)�ĪŻ╚ń┤╬┬╚╦ß(HClO)ųą┬╚Ą─ār(ji©ż)æB(t©żi)▒╚Ė▀┬╚╦ß(HClO4)ųą┬╚Ą─ār(ji©ż)æB(t©żi)Ą═��Ż¼Ą½┤╬┬╚╦ß▓╗ĘĆČ©�Ż¼č§╗»ąįģs▒╚Ė▀┬╚╦ßÅŖ��ĪŻ┴Ē═ŌūŅĖ▀ār(ji©ż)æB(t©żi)Ą─╬’┘|(zh©¼)ę▓▓╗ę╗Č©Č╝▒Ē¼FÅŖč§╗»ąį��Ż¼╚ńH3PO4�����ĪŻ
č§╗»ąį�����Īó▀ĆįŁąįÅŖ╚§Ą─┼ąöÓ
ę╗�����Īóč§╗»ąį���Īó▀ĆįŁąįĄ─Ė┼─Ņ�����Īó└ĒĮŌ╝░┼ąöÓ
1.č§╗»ąį╩ŪųĖ╬’┘|(zh©¼)Ą├ļŖūėĄ─ąį┘|(zh©¼)(╗“─▄┴”);▀ĆįŁąį╩ŪųĖ╬’┘|(zh©¼)╩¦ļŖūėĄ─ąį┘|(zh©¼)(╗“─▄┴”)�����ĪŻ
2.č§╗»ąį�����Īó▀ĆįŁąįĄ─ÅŖ╚§╚ĪøQė┌╬’┘|(zh©¼)Ą├����Īó╩¦ļŖūėĄ─ļyęū│╠Č╚��Ż¼┼cĄ├���Īó╩¦ļŖūėĄ─öĄ─┐¤o(w©▓)ĻP(gu©Īn)��Ż¼╚ńNa-e-===Na+����ĪóAl-3e-===Al3+����Ż¼Ą½Ė∙ō■Įī┘╗Ņäė(d©░ng)ąįĒśą“▒Ē�����Ż¼Na▒╚Al╗ŅØŖ�Ż¼Ė³ęū╩¦╚źļŖūė���Ż¼╦∙ęįNa▒╚AlĄ─▀ĆįŁąįÅŖ��ĪŻ
3.Å─į¬╦žĄ─ār(ji©ż)æB(t©żi)┐╝æ]Ż║ūŅĖ▀ār(ji©ż)æB(t©żi)——ų╗ėąč§╗»ąį�Ż¼╚ńFe3+�ĪóH2SO4���ĪóKMnO4Ą╚;ūŅĄ═ār(ji©ż)æB(t©żi)——ų╗ėą▀ĆįŁąį�����Ż¼╚ńĮī┘å╬┘|(zh©¼)��ĪóCl-�ĪóS2-Ą╚;ųąķgār(ji©ż)æB(t©żi)——╝╚ėąč§╗»ąįėųėą▀ĆįŁąį��Ż¼╚ńFe2+�����ĪóS�����ĪóCl2Ą╚��ĪŻ
Č■�Īóč§╗»ąį��Īó▀ĆįŁąįÅŖ╚§Ą─▒╚▌^ĘĮĘ©
č§╗»ąį�Īó▀ĆįŁąįĄ─ÅŖ╚§ų„ę¬╚ĪøQė┌╬’┘|(zh©¼)Ą├╩¦ļŖūėĄ─ļyęū│╠Č╚���Ż¼┼cĄ├╩¦ļŖūėĄ─öĄ─┐¤o(w©▓)ĻP(gu©Īn)�����ĪŻ┴Ē═Ō▀ĆĖ·Ę┤æ¬Ą─Śl╝■���Ż¼╚ń╚▄ę║Ą─╦ßēAąį�����ĪóØŌČ╚���Īó£žČ╚Ą╚ę“╦žėąĻP(gu©Īn)���Ż¼┐╔ę└ō■ęįŽ┬ÄūéĆ(g©©)ĘĮ├µ┼ąöÓŻ║
1.ę└ō■į¬╦žų▄Ų┌▒Ē
(1)═¼ų▄Ų┌Å─ū¾ĄĮėę�Ż¼Įī┘į¬╦žå╬┘|(zh©¼)Ą─▀ĆįŁąįųØu£p╚§�����Ż¼ī”æ¬Ļ¢(y©óng)ļxūėĄ─č§╗»ąįųØuį÷ÅŖ;ĘŪĮī┘į¬╦žå╬┘|(zh©¼)Ą─č§╗»ąįųØuį÷ÅŖ��Ż¼ī”æ¬ĻÄļxūėĄ─▀ĆįŁąįųØu£p╚§�ĪŻ
(2)═¼ų„ūÕÅ─╔ŽĄĮŽ┬����Ż¼Įī┘į¬╦žå╬┘|(zh©¼)Ą─▀ĆįŁąįųØuį÷ÅŖ�Ż¼ī”æ¬Ļ¢(y©óng)ļxūėĄ─č§╗»ąįųØu£p╚§;ĘŪĮī┘į¬╦žå╬┘|(zh©¼)Ą─č§╗»ąįųØu£p╚§�����Ż¼ī”æ¬ĻÄļxūėĄ─▀ĆįŁąįųØuį÷ÅŖ����ĪŻ
2.ę└ō■Įī┘���ĪóĘŪĮī┘╗Ņäė(d©░ng)ąįĒśą“
(1)ę└ō■Įī┘╗Ņäė(d©░ng)ąįĒśą“

3.ę└ō■Ę┤æ¬įŁ└Ē
č§╗»ä®+▀ĆįŁä®©D→▀ĆįŁ«a(ch©Żn)╬’+č§╗»«a(ch©Żn)╬’
č§╗»ąįŻ║č§╗»ä®>č§╗»«a(ch©Żn)╬’
▀ĆįŁąįŻ║▀ĆįŁä®>▀ĆįŁ«a(ch©Żn)╬’
4.ę└ō■Ę┤æ¬Śl╝■╝░Ę┤æ¬Ą─äĪ┴ę│╠Č╚
Ę┤æ¬Śl╝■ę¬Ū¾įĮĄ═�����Ż¼Ę┤æ¬įĮäĪ┴ę�Ż¼ī”æ¬╬’┘|(zh©¼)Ą─č§╗»ąį╗“▀ĆįŁąįįĮÅŖ�����Ż¼╚ń╩Ūʱ╝ė¤ß���Īóėą¤o(w©▓)┤▀╗»ä®╝░Ę┤欣žČ╚Ė▀Ą═║═Ę┤æ¬╬’ØŌČ╚┤¾ąĪĄ╚�ĪŻ
└²╚ńŻ║2KMnO4+16HCl(ØŌ)===2KCl+2MnCl2+5Cl2↑+8H2O���Ż¼
MnO2+4HCl(ØŌ)Ī„MnCl2+Cl2↑+2H2O����Ż¼
4HCl+O2┤▀╗»ä®2H2O+2Cl2��Ż¼
ė╔╔Ž╩÷Ę┤æ¬Śl╝■Ą─▓╗═¼�����Ż¼┐╔┼ąöÓč§╗»ąįŻ║
KMnO4>MnO2>O2����ĪŻ
5.ę└ō■č§╗»▀ĆįŁĘ┤æ¬Ą─│╠Č╚
(1)ŽÓ═¼Śl╝■Ž┬�Ż¼▓╗═¼č§╗»ä®╩╣═¼ę╗ĘN▀ĆįŁä®▒╗č§╗»│╠Č╚┤¾Ą─��Ż¼Ųõč§╗»ąįÅŖ�����ĪŻ└²╚ń
2Fe+3Cl2³c(di©Żn)╚╝2FeCl3�Ż¼Fe+SĪ„FeS���Ż¼
č§╗»ąįŻ║Cl2>S���ĪŻ
(2)ŽÓ═¼Śl╝■Ž┬����Ż¼▓╗═¼▀ĆįŁä®╩╣═¼ę╗ĘNč§╗»ä®▒╗▀ĆįŁ│╠Č╚┤¾Ą─�����Ż¼Ųõ▀ĆįŁąįÅŖ����ĪŻ└²╚ń
Cu+2Fe3+===Cu2++2Fe2+���Ż¼
3Zn+2Fe3+===3Zn2++2Fe����Ż¼
▀ĆįŁąįŻ║Zn>Cu�����ĪŻ
6.ę└ō■ļŖ╗»īW(xu©”)įŁ└Ē
įŁļŖ│žųą�Ż¼žōśO╬’┘|(zh©¼)Ą─▀ĆįŁąįę╗░ŃÅŖė┌š²śO╬’┘|(zh©¼);ė├ČĶąįļŖśOļŖĮŌ╗ņ║Ž╚▄ę║Ģr(sh©¬)��Ż¼į┌ĻÄśOŽ╚Ę┼ļŖĄ─Ļ¢(y©óng)ļxūėĄ─č§╗»ąįÅŖ��Ż¼į┌Ļ¢(y©óng)śOŽ╚Ę┼ļŖĄ─ĻÄļxūėĄ─▀ĆįŁąįÅŖ���ĪŻ
7.─│ą®č§╗»ä®Ą─č§╗»ąį╗“▀ĆįŁä®Ą─▀ĆįŁąį┼cŽ┬┴ąę“╦žėąĻP(gu©Īn)
£žČ╚Ż║╚ń¤ßĄ─ØŌ┴“╦ߥ─č§╗»ąį▒╚└õĄ─ØŌ┴“╦ߥ─č§╗»ąįÅŖ����ĪŻ
ØŌČ╚Ż║╚ńØŌŽ§╦ߥ─č§╗»ąį▒╚ŽĪŽ§╦ߥ─ÅŖ���ĪŻ
╦ßēAąįŻ║╚ńKMnO4╚▄ę║Ą─č§╗»ąįļS╚▄ę║╦ßąįĄ─į÷ÅŖČ°į÷ÅŖ�ĪŻ
╦─éĆ(g©©)▓╗
1.į¬╦ž╠Äė┌ūŅĖ▀ār(ji©ż)æB(t©żi)Ģr(sh©¬)ų╗ėąč§╗»ąį�����Ż¼Ą½▓╗ę╗Č©ėąÅŖč§╗»ąį���Ż¼╚ńNa+��ĪóSO4(2-);═¼└Ē��Ż¼į¬╦ž╠Äė┌ūŅĄ═ār(ji©ż)æB(t©żi)Ģr(sh©¬)ę▓▓╗ę╗Č©Š▀ėąÅŖ▀ĆįŁąį����ĪŻ
2.ī”ė┌ę╗ĘN╬’┘|(zh©¼)╝╚ū„č§╗»ä®ėųū„▀ĆįŁä®Ą─Ę┤æ¬�Ż¼╚ńCl2+H2O??HClO+HCl����Ż¼▓╗─▄Ė∙ō■Ę┤æ¬ĘĮ│╠╩Į┼ąöÓ╬’┘|(zh©¼)č§╗»ąį�����Īó▀ĆįŁąįĄ─ÅŖ╚§��ĪŻ
3.ę└ō■Įī┘╗Ņäė(d©░ng)ąįĒśą“┼ąöÓĻ¢(y©óng)ļxūėĄ─č§╗»ąįÅŖ╚§Ģr(sh©¬)����Ż¼ę¬ūóęŌFeī”æ¬Ą─Ļ¢(y©óng)ļxūė╩ŪFe2+�Ż¼Č°▓╗╩ŪFe3+��ĪŻ
4.║¼ėą═¼ĘNį¬╦ž▓╗═¼ār(ji©ż)æB(t©żi)Ą─╬’┘|(zh©¼)��Ż¼ār(ji©ż)æB(t©żi)įĮĖ▀Ųõč§╗»ąį▓╗ę╗Č©įĮÅŖ��ĪŻ╚ńč§╗»ąįHClO>HClO4�����ĪŻ
╝┘įOĘ©┼ąöÓč§╗»▀ĆįŁĘ┤æ¬─▄ʱ▀M(j©¼n)ąą
ęčų¬╬’┘|(zh©¼)Ą─č§╗»ąį╗“š▀▀ĆįŁąįĄ─ÅŖ╚§ĻP(gu©Īn)ŽĄ���Ż¼┼ąöÓ─│ę╗č§╗»▀ĆįŁĘ┤æ¬─▄ʱ░l(f©Ī)╔·Ģr(sh©¬)┐╔▓╔ė├╝┘įOĘ©�����ĪŻ
Ž╚╝┘įOĘ┤æ¬│╔┴ó
⇩
╚╗║¾Ė∙ō■č§╗»ä®Ą─č§╗»ąį>č§╗»«a(ch©Żn)╬’Ą─č§╗»ąį����Ż¼▀ĆįŁä®Ą─▀ĆįŁąį>▀ĆįŁ«a(ch©Żn)╬’Ą─▀ĆįŁąįĄ─ęÄ┬╔�Ż¼┴ą│÷╝┘įOĘ┤æ¬ųąĄ─╔Ž╩÷ĻP(gu©Īn)ŽĄ
⇩
ĮY║ŽŅ}Ė╔Śl╝■┼ąöÓįōĮYšō╩ŪĘ±Ę¹║Ž╩┬īŹ(sh©¬)����ĪŻĘ¹║Ž╩┬īŹ(sh©¬)����Ż¼ätĘ┤æ¬│╔┴ó;Ę┤ų«���Ż¼ät▓╗│╔┴ó
╩ž║ŃĘ©ĮŌŅ}Ą─“3▓Į┴„│╠”

č§╗»▀ĆįŁĘ┤æ¬Ą─┼õŲĮ╝░▒Ē╩ŠĘĮĘ©
1.č§╗»▀ĆįŁĘ┤æ¬ĘĮ│╠╩ĮĄ─┼õŲĮ
(1)┼õŲĮĘĮĘ©
ó┘ę╗ś╦Ż║ś╦│÷Ę┤æ¬Ū░║¾ūāār(ji©ż)į¬╦žĄ─╗»║Žār(ji©ż)�ĪŻ
ó┌Č■Ą╚Ż║Ę┤æ¬ųą╔²ār(ji©ż)┐éöĄ║═ĮĄār(ji©ż)┐éöĄŽÓĄ╚����ĪŻ
ó█╚²Č©Ż║┤_Č©╗»║Žār(ji©ż)░l(f©Ī)╔·ūā╗»Ą─╬’┘|(zh©¼)Ą─╗»īW(xu©”)ėŗ┴┐öĄ��ĪŻ
ó▄╦─ŲĮŻ║ė├ė^(gu©Īn)▓ņĘ©┼õŲĮŲõ╦¹Ė„╬’┘|(zh©¼)Ą─╗»īW(xu©”)ėŗ┴┐öĄ���ĪŻ
ó▌╬Õ▓ķŻ║Öz▓ķĘ┤æ¬Ū░║¾╩Ūʱū±čŁ┘|(zh©¼)┴┐╩ž║Ń║═ļŖūė╩ž║Ń�ĪŻ
(2)īŹ(sh©¬)└²Ż║Ń~┼cØŌH2SO4░l(f©Ī)╔·Ę┤æ¬Ą─╗»īW(xu©”)ĘĮ│╠╩ĮŻ║
2H2SO4(ØŌ)+CuĪ„(=====)CuSO4+SO2↑+2H2O�ĪŻ
2.ļpŠĆ(xi©żn)ś“Ę©
(1)▒Ē╩ŠĘĮĘ©Ż║╝²Ņ^ė╔Ę┤æ¬╬’ųĖŽ“╔·│╔╬’Ą─ī”æ¬į¬╦ž���Ż¼▓óį┌ŠĆ(xi©żn)ś“╔Žś╦├„ļŖūė║═“Ą├”╝░“╩¦”ūųśė����ĪŻ
(2)īŹ(sh©¬)└²Ż║Cu┼cŽĪŽ§╦ßĘ┤æ¬▀^(gu©░)│╠ųąļŖūė▐DęŲĄ─ĘĮŽ“║═öĄ─┐┐╔▒Ē╩Š×ķ
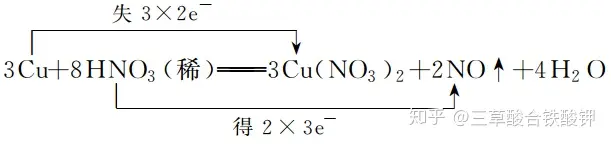
3.å╬ŠĆ(xi©żn)ś“Ę©
(1)▒Ē╩ŠĘĮĘ©Ż║╝²Ņ^ė╔╩¦ļŖūėįŁūėųĖŽ“Ą├ļŖūėįŁūė�Ż¼ŠĆ(xi©żn)ś“╔Žų╗ś╦▐DęŲļŖūėöĄ─┐�����Ż¼▓╗ś╦ļŖūėĄ─“Ą├”“╩¦”ūųśė���ĪŻ
(2)īŹ(sh©¬)└²Ż║Cu┼cØŌHNO3Ę┤æ¬▀^(gu©░)│╠ųąļŖūė▐DęŲĄ─ĘĮŽ“║═öĄ─┐┐╔▒Ē╩Š×ķ
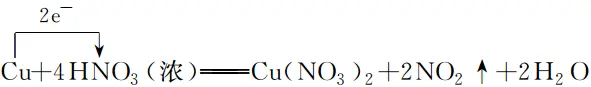
1.ūóęŌ╠ž╩Ō╬’┘|(zh©¼)ųąį¬╦žĄ─╗»║Žār(ji©ż)���Ż¼╚ńCuFeS2ųąŃ~�ĪóĶFį¬╦žĄ─╗»║Žār(ji©ż)Č╝×ķ+2ār(ji©ż)�����Ż¼┴“į¬╦žĄ─╗»║Žār(ji©ż)×ķ-2ār(ji©ż);FeS2ųą┴“į¬╦žĄ─╗»║Žār(ji©ż)×ķ-1ār(ji©ż);K2FeO4ųąĶFį¬╦žĄ─╗»║Žār(ji©ż)×ķ+6ār(ji©ż)Ą╚���ĪŻ
2.┼õŲĮ╗»īW(xu©”)ĘĮ│╠╩ĮĢr(sh©¬)����Ż¼╗»īW(xu©”)ėŗ┴┐öĄ“1”ę▓▒žĒÜ╠Ņīæ(xi©¦)į┌┐šĖ±└’���ĪŻ
3.ę└ō■ļŖūėĄ├╩¦╩ž║Ń┴ąĄ╚╩ĮĢr(sh©¬)▓╗ę¬║÷┬įūāār(ji©ż)įŁūėĄ─éĆ(g©©)öĄ����ĪŻ
1.ūóęŌ╠ž╩Ō╬’┘|(zh©¼)ųąį¬╦žĄ─╗»║Žār(ji©ż)���Ż¼╚ńCuFeS2ųąŃ~����ĪóĶFį¬╦žĄ─╗»║Žār(ji©ż)Č╝×ķ+2ār(ji©ż)�����Ż¼┴“į¬╦žĄ─╗»║Žār(ji©ż)×ķ-2ār(ji©ż);FeS2ųą┴“į¬╦žĄ─╗»║Žār(ji©ż)×ķ-1ār(ji©ż);K2FeO4ųąĶFį¬╦žĄ─╗»║Žār(ji©ż)×ķ+6ār(ji©ż)Ą╚��ĪŻ
2.┼õŲĮ╗»īW(xu©”)ĘĮ│╠╩ĮĢr(sh©¬)��Ż¼╗»īW(xu©”)ėŗ┴┐öĄ“1”ę▓▒žĒÜ╠Ņīæ(xi©¦)į┌┐šĖ±└’���ĪŻ
3.ę└ō■ļŖūėĄ├╩¦╩ž║Ń┴ąĄ╚╩ĮĢr(sh©¬)▓╗ę¬║÷┬įūāār(ji©ż)įŁūėĄ─éĆ(g©©)öĄ���ĪŻ
╬ęĄ─┐éĮY
į┌╚½ć°ŠĒųą�����Ż¼┐╝Ņ}Ą─ŪķŠ░─Żą═ėą╚ńŽ┬4ĘN�����Ż¼ąĶę¬└ĒĮŌ║═æ¬ė├Ą─ĮŌŅ}ĘĮĘ©ėą╚ńŽ┬4Śl�����ĪŻ

č§╗»▀ĆįŁĘ┤æ¬ĘĮ│╠╩ĮĄ─┼õŲĮ
1.┼õŲĮĄ─╚²┤¾╩ž║ŃįŁät
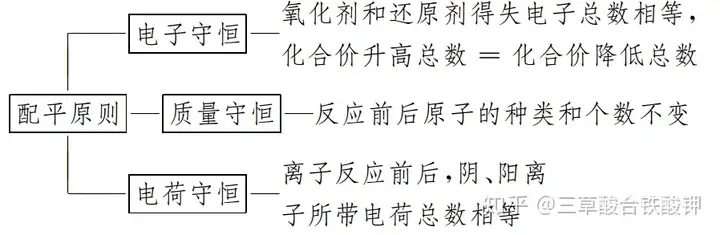
2.┼õŲĮĄ─╚²ĘNĘĮĘ©╝╝Ū╔
(1)š²Ž“┼õŲĮĘ©Ż║▀m║ŽĘ┤æ¬╬’Ęųäe╩Ūč§╗»ä®���Īó▀ĆįŁä®Ą─Ę┤æ¬�Ż¼┼õŲĮ░┤ęįŽ┬4▓Į▀M(j©¼n)ąą���ĪŻ

(2)─µŽ“┼õŲĮĘ©Ż║▀mė├ė┌ę╗ĘNį¬╦žĄ─╗»║Žār(ji©ż)╝╚╔²Ė▀ėųĮĄĄ═Ą─Ę┤æ¬║═ĘųĮŌĘ┤æ¬ųąĄ─č§╗»▀ĆįŁĘ┤æ¬���ĪŻŽ╚┤_Č©╔·│╔╬’Ą─╗»īW(xu©”)ėŗ┴┐öĄ�Ż¼╚╗║¾į┘┤_Č©Ę┤æ¬╬’Ą─╗»īW(xu©”)ėŗ┴┐öĄ�����ĪŻ
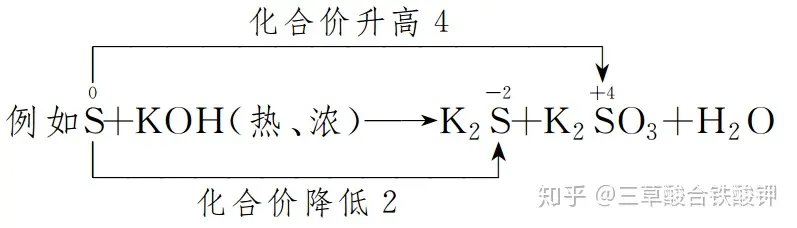
ė╔ė┌SĄ─╗»║Žār(ji©ż)╝╚╔²ėųĮĄ���Ż¼Č°Ūę╔²ĮĄ┐éöĄę¬ŽÓĄ╚����Ż¼╦∙ęįK2SĄ─╗»īW(xu©”)ėŗ┴┐öĄ×ķ2����Ż¼K2SO3Ą─╗»īW(xu©”)ėŗ┴┐öĄ×ķ1����Ż¼╚╗║¾┤_Č©SĄ─╗»īW(xu©”)ėŗ┴┐öĄ×ķ3�����ĪŻ
(3)ŲµöĄ┼õ┼╝Ę©Ż║▀mė├ė┌╬’┘|(zh©¼)ĘNŅÉ(l©©i)╔┘ŪęĘųūėĮM│╔║å(ji©Żn)å╬Ą─č§╗»▀ĆįŁĘ┤æ¬�����ĪŻ╚ńS+C+KNO3©D→CO2↑+N2↑+K2S�����Ż¼Ę┤æ¬╬’KNO3ųą╚²ĘNį¬╦žįŁūėöĄŠ∙×ķŲµöĄ��Ż¼Č°╔·│╔╬’ųą╚²ĘNį¬╦žĄ─įŁūėöĄŠ∙×ķ┼╝öĄ�Ż¼╣╩┐╔īóKNO3│╦ęį2��Ż¼╚╗║¾ė├ė^(gu©Īn)▓ņĘ©┼õŲĮĄ├Ż║S+3C+2KNO3===3CO2↑+N2↑+K2S��ĪŻ
1.┼õŲĮĘĮĘ©
Ž╚ė├“╗»║Žār(ji©ż)╔²ĮĄĘ©”┼õŲĮ║¼ėąūāār(ji©ż)į¬╦žĄ─╬’┘|(zh©¼)Ą─╗»īW(xu©”)ėŗ┴┐öĄ����Ż¼╚╗║¾į┘Ė∙ō■įŁūė╩ž║Ń▀M(j©¼n)ąą┼õŲĮ����ĪŻ
2.čaĒŚįŁät
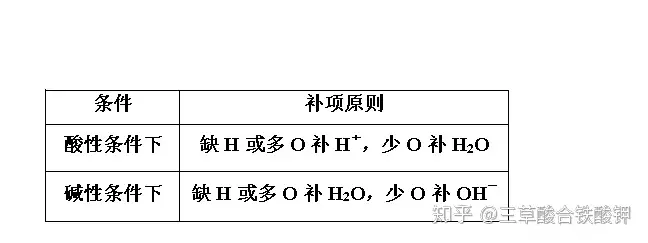
3.ĮM║ŽĘĮ╩Į
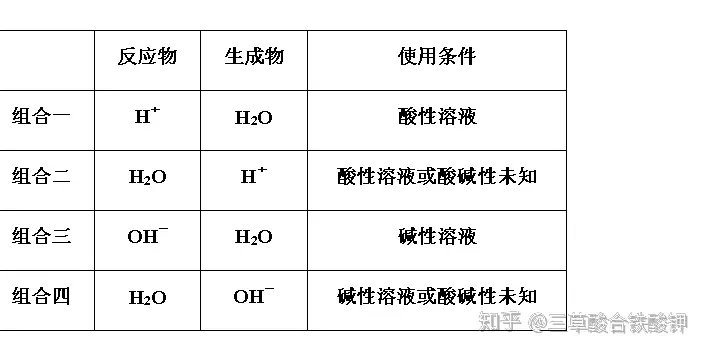
ą┼Žóą═č§╗»▀ĆįŁĘ┤æ¬ĘĮ│╠╩ĮĄ─Ģ°(sh©▒)īæ(xi©¦)

ĪĪĪĪ ÜgėŁ╩╣ė├╩ųÖC����ĪóŲĮ░ÕĄ╚ęŲäė(d©░ng)įOéõįL(f©Żng)å¢(w©©n)ųą┐╝ŠW(w©Żng)����Ż¼2024ųą┐╝ę╗┬Ę┼Ń░ķ═¼ąą���ŻĪ>>³c(di©Żn)ō¶▓ķ┐┤